2. Химическая связь и строение молекул
Почему атомы соединяются в молекулы? Какими силами они в ней удерживаются? Какова природа этих сил? Почему молекулы имеют определенную форму? Это центральные вопросы химии, т.к. свойства веществ, их реакционная способность зависят от состава, строения и типа химической связи между атомами.
После открытия электронного строения атомов стало возможным объяснить природу химической связи и установить роль электронов в образовании химической связи.
Известно, что атомы имеют на внешнем уровне от 1 до 8 электронов. Если на внешнем уровне содержится максимальное число электронов - 8, то уровень считается завершенным и отличается большой прочностью (благородные газы). У других атомов уровни незавершенные и они в процессе химической реакции стремятся их завершить, что достигается присоединением или отдачей электронов, либо образованием общих электронных пар. Химическая связь осуществляется валентными электронами: у s- и p- элементов это электроны внешнего уровня с s- и p- подуровня, у d- элементов это электроны d- подуровня предвнешнего уровня и электроны s-подуровня внешнего уровня.
Химическая связь осуществляется по-разному, поэтому различают: ковалентную, ионную и металлическую связь. Кроме того, между молекулами возникает водородная химическая связь, и происходят вандерваальсовы взаимодействия.
2.1. Параметры
химической связи
Энергия связи. Химическая связь возникает лишь в том случае, если полная энергия взаимодействующих атомов уменьшается, т.е. при образовании связи должна всегда выделяться энергия.
Количество
энергии, выделяющейся при образовании химической связи, называется энергией
связи EСВ (кДж/моль).
Энергия связи является мерой прочности связи. Чем больше выделяется энергии при образовании молекулы, тем больше энергии надо затратить на разрыв, т.е. тем молекула прочнее.
Расстояние между химически связанными атомами называют длиной связи.
Она зависит от размеров электронных оболочек и степени их перекрывания. С уменьшением длины связи обычно растет энергия связи и устойчивость молекул. Например, в ряду от HF до HI длина связи растет, а ее энергия уменьшается.
Валентный угол – угол, образуемый линиями, проходящими через ядра атомов.
Ионная химическая связь возникает при электростатическом взаимодействии отрицательно и положительно заряженных ионов в химическом соединении. Эта связь возникает лишь в случае большой разности ЭО атомов, например, между катионами s- металлов первой и второй групп периодической системы и анионами неметаллов шестой и седьмой групп (LiF, СsСl, NaCl и др.)
При образовании катионов и анионов могут возникать устойчивые восьмиэлектронные (октетные) конфигурации. Атомы и ионы с одинаковыми электронными конфигурациями образуют изоэлектронные ряды, например ряды неона, аргона, криптона:
Ne, O2‾, F‾, Na+, Mg2+, Al3+ - 1s22s22p6 или [Ne]
Ar, S2‾, Cl‾, K+, Ca2+, Sc3+ ‑ [Ne] 3s23p6 или [Ar]
Kr, Se2‾, Br‾, Rb+, Sr2+, Y3+ - [Ar] 3d104s23p6 или [Kr]
Так как электрическое поле иона имеет сферический характер, то для ионной связи не характерна направленность и насыщаемость. Поэтому ион способен взаимодействовать с соседними ионами противоположного знака в любом количестве и в любом направлении. Вещества с ионной связью представляют собой кристаллические вещества, существующие в виде гигантских молекул NanCln.
Химическая связь, образованная путем обобществления пары электронов двух атомов, называется ковалентной связью.
 Рассмотрим
образование ковалентной связи в молекуле водорода. При сближении атомов водорода
происходит проникновение их электронных облаков друг в друга и их частичное
перекрывание. Электронная плотность между ядрами возрастает. Ядра притягиваются
друг к другу, вследствие этого снижается энергия системы. При очень сильном
сближении атомов возрастает отталкивание ядер. Поэтому имеется оптимальное
расстояние (длина связи r0) между ядрами, при котором система
имеет минимальную энергию. При таком состоянии выделяется энергия EСВ, называемая энергией связи (рис. 2).
Рассмотрим
образование ковалентной связи в молекуле водорода. При сближении атомов водорода
происходит проникновение их электронных облаков друг в друга и их частичное
перекрывание. Электронная плотность между ядрами возрастает. Ядра притягиваются
друг к другу, вследствие этого снижается энергия системы. При очень сильном
сближении атомов возрастает отталкивание ядер. Поэтому имеется оптимальное
расстояние (длина связи r0) между ядрами, при котором система
имеет минимальную энергию. При таком состоянии выделяется энергия EСВ, называемая энергией связи (рис. 2).
2.3.1. Свойства
ковалентной связи
1. Насыщаемость- способность атомов образовывать ограниченное число ковалентных связей. Например, нельзя присоединить еще один атом водорода к молекуле H2 или HCl так как спин электрона водорода окажется параллельным спину одного из электронов в связующей электронной паре и будет происходить отталкивание водорода. Благодаря насыщаемости связей молекулы имеют определенный состав: H2, а не H3; HCl, а не H2Cl и т.д.
2. Направленность ковалентной связи определяет пространственную структуру молекул. Так как атомные орбитали пространственно ориентированы, то перекрывание электронных облаков происходит по определенным направлениям, что и обусловливает направленность ковалентной связи. Количественно направленность выражается в виде валентных углов между направлениями химической связи в молекулах.
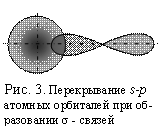 Рассмотрим
это на примере образования HCl. Как известно, ковалентная связь возникает в направлении
максимального перекрывания электронных облаков (орбиталей) вдоль линии
взаимодействующих атомов: (рис. 3). При образовании молекулы HCl происходит
перекрывание s-
орбитали атома водорода с р-орбиталью атома хлора
и молекула имеет линейную форму.
Рассмотрим
это на примере образования HCl. Как известно, ковалентная связь возникает в направлении
максимального перекрывания электронных облаков (орбиталей) вдоль линии
взаимодействующих атомов: (рис. 3). При образовании молекулы HCl происходит
перекрывание s-
орбитали атома водорода с р-орбиталью атома хлора
и молекула имеет линейную форму.
3. Полярность ковалентной связи. Если ковалентная связь образована одинаковыми атомами, например, Н - Н, О = О, Cl - Cl, то обобществленные электроны равномерно распределены между ними. Такая связь называется ковалентной неполярной. Если же один из атомов сильнее притягивает электроны, то электронная пара смещается в сторону этого атома и в этом случае возникает полярная ковалентная связь. Критерием способности атома притягивать электрон может служить электроотрицательность (ЭО). Чем выше ЭО у атома, тем вероятнее смещение электронной пары в сторону ядра этого атома.
Вследствие смещения электронной пары к одному из ядер повышается плотность отрицательного заряда у данного атома, и атом получает заряд, называемый эффективным зарядом атома δ‾. У второго атома повышается плотность положительного заряда δ+. Вследствие этого возникает диполь, представляющий собой нейтральную частицу с одинаковыми по величине положительными и отрицательными зарядами, находящимися на определенном расстоянии (длина диполя) lд друг от друга. Мерой полярности связи служит электрический момент диполя μсв, равный произведению эффективного заряда на длину диполя:
![]()
Для объяснения свойств химической связи в настоящее время применяют разнообразные приближенные теории, часто сильно отличающиеся друг от друга. Из методов квантовой химии наиболее известны два подхода к расчету молекулярных систем- метод валентных связей (МВС) и метод молекулярных орбиталей (ММО).
Впервые метод валентных связей был применен немецкими учеными в 1927 г. Гейтлером В. и Лондоном Ф. для рассмотрения образования молекулы Н2. Они рассмотрели систему из двух атомов водорода находящихся на большом расстоянии друг от друга. При этом электрон взаимодействовал только со своим ядром. При сближении атомов происходило притяжение ядер с электронами и отталкивание электронов и атомов. В результате взаимодействия ядер и электронов получается зависимость потенциальной энергии Е системы от расстояния r между ядрами этих атомов. При этом оказалось, что результаты зависят от того, одинаковы или противоположны по знаку спины взаимодействующих электронов. При совпадении спинов электронов кривая 2 сближения атомов приводит к непрерывному возрастанию энергии системы. Для сближения атомов требуется затрата энергии, такой процесс энергетически невыгоден и химическая связь между атомами не возникает. При противоположно направленных спинах (кривая 1) сближение атомов до расстояния r0 сопровождается уменьшением энергии системы. При r = r0 система обладает наименьшей потенциальной энергией, т.е. находится в устойчивом состоянии; дальнейшее сближение атомов приводит к возрастанию энергии. Т.е. в случае противоположно направленных спинов электронов образуется молекула Н2 - устойчивая система из двух атомов водорода, находящихся на определенном расстоянии друг от друга (рис. 2)
При образовании химической связи происходит перекрывание электронных облаков взаимодействующих атомов. Вследствие образования области с высокой плотностью электрического заряда в межъядерном пространстве происходит стягивание ядер атомов и образуется устойчивая молекула.
Позднее метод ВС был распространен и на другие молекулы.
2.3.3. Основные положения метода валентных
связей
1. Ковалентная химическая связь образуется двумя электронами с противоположно направленными спинами, принадлежащими двум атомам.
2. Ковалентная связь тем прочнее, чем в большей степени перекрываются взаимодействующие электронные облака.
3. Характеристики химической связи определяются типом перекрывания АО.
4. Ковалентная связь направлена в сторону максимального перекрывания АО реагирующих атомов.
Образование молекулы водорода
![]()
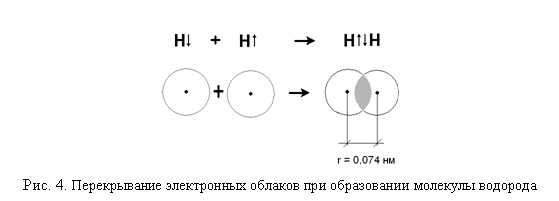
можно представить следующим образом: (рис.4)
При образовании химической связи изменения претерпевают лишь электронные структуры внешних оболочек, которая и определяет природу и свойства атома. Поэтому в молекуле не существует атома с исходной электронной структурой атома. У атомов в молекуле не изменяются лишь электронные конфигурации внутренних электронных оболочек.
2.3.4. Валентность
по методу ВС
Валентность - это способность атома образовывать химические связи с другим атомом за счет неспаренных электронов в основном или в возбужденном состоянии.
Ими могут быть неспаренные электроны внешних оболочек у s-и р- элементов, внешних и предвнешних оболочек у d- элементов, внешних, предвнешних и предпредвнешних оболочек у f- элементов.
При образовании химической связи атом может переходить в возбужденное состояние, разъединяя пары электронов и переводя их на свободные (вакантные) атомные орбитали того же уровня.
Так, элемент 7 группы фтор имеет одну валентность, равную 1, а хлор - 1, 3, 5, 7. Это объясняется тем, что у фтора нет на 2-ом энергетическом уровне свободных АО, тогда как у хлора на 3-м энергетическом уровне имеется 9 АО, из которых электронами заняты 4. При возбуждении атома хлора происходит распаривание электронов и постепенный переход их на свободные d- орбитали.
У атомов d-
и f- элементов на внешних
уровнях в основном состоянии нет неспаренных электронов, поэтому их валентность равна 0, несмотря на то,
что на предвнешних d-
и f- подуровнях имеются
неспаренные электроны. Но они не могут образовать электронные пары с другими
атомами, т.к. закрыты электронами внешнего уровня. При возбуждении атома
распаренные электроны внешнего уровня вступают в химическую связь и открывают
внутренние электронные уровни. Например, валентность железа в основном
состоянии равна 0:
|
|
3d |
|
4s |
|
4p |
|
||||||
|
Fe |
↓↑ |
↑ |
↑ |
↑ |
↑ |
|
↓↑ |
|
|
|
|
B = 0 |
В возбужденном состоянии происходит разъединение 4s- пары электронов:
|
|
3d |
|
4s |
|
4p |
|
||||||
|
Fe* |
↓↑ |
↑ |
↑ |
↑ |
↑ |
|
↑ |
|
↓ |
|
|
B* = 2, 3, 4, 5, 6 |
Валентность железа в возбужденном состоянии определяется не только 4s-, 4p-, но и 3d- неспаренными электронами. Пара 3d-электронов не может разъединиться, потому что на 3 уровне нет вакантных орбиталей, поэтому максимальная валентность железа равна 6.
У осмия при возбуждении могут
разъединяться не только внешние 6s-
электроны, но и предвнешние 5d-
электроны, т.к. на 5 уровне есть еще 5f-подуровень
со свободными орбиталями. Поэтому максимальная валентность осмия равна 8:
|
|
5d |
|
5f |
|
6s |
|
6p |
|
|||||||||||||
|
Os |
↓↑ |
↑ |
↑ |
↑ |
↑ |
|
|
|
|
|
|
|
|
|
↓↑ |
|
|
|
|
B = 0 |
|
|
|
5d |
|
5f |
|
6s |
|
6p |
|
||||||||||||
|
Os* |
↑ |
↑ |
↑ |
↑ |
↑ |
|
↓ |
|
|
|
|
|
|
|
↑ |
|
↓ |
|
|
B* = 2, 3, 4, 5, 6, 8 |
2.3.5. Гибридизация
атомных орбиталей
 Обычно
атомы формируют связи за счет электронов разных энергетических состояний –s-р-d-состояний,
но, несмотря на различие форм исходных облаков, образованные связи оказываются равноценными.
Оказывается, химические связи образуются не чистыми, а смешанными, так
называемыми гибридными
орбиталями.
Обычно
атомы формируют связи за счет электронов разных энергетических состояний –s-р-d-состояний,
но, несмотря на различие форм исходных облаков, образованные связи оказываются равноценными.
Оказывается, химические связи образуются не чистыми, а смешанными, так
называемыми гибридными
орбиталями.
Гибридизация – это явление смешения АО или электронных облаков, приводящее к образованию новых гибридных облаков одинаковой формы и одинаковой энергии.
Гибридные орбитали вытянуты по направлению к соседним атомам, что приводит к более полному перекрыванию электронных орбиталей, образованию более прочной химической связи и к выигрышу энергии.
Форма гибридной АО отличается от формы исходных АО (рис. 6)
Ковалентная связь, которая образуется при перекрывании АО вдоль линии, связывающей ядра взаимодействующих атомов, называется σ– связью (сигма связь) (рис. 6).
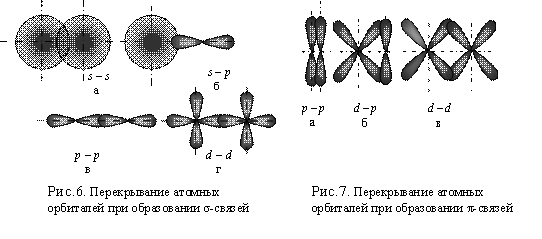
σ– связь может возникать при
перекрывании s-
орбиталей, s-
и р- орбиталей, р-
орбиталей, d-
орбиталей (рис.6 а, б, в, г), а также d-
и s- орбиталей, d- и р–
орбиталей. σ– связь обычно
объединяет два атома, поэтому является локализованной двухцентровой связью.
Связь, образованная перекрыванием АО по обе стороны линии, соединяющей ядра атомов, называется π– связью (пи связь). π– связь может образоваться при перекрывании р-р- орбиталей, р-d- орбиталей, d-d- орбиталей (рис.7 а, б, в), а также f-p-, f-d- и f-f- орбиталей.
Связь, образованная перекрыванием d- орбиталей всеми
четырьмя лепестками, называется δ- связью
(дельта связь) (рис. 8). 
Соответственно, s- элементы могут образовывать лишь σ– связи, р- элементы - σ– и π– связи, d- элементы - σ–, π– и δ‑ связи, а f- элементы - σ– , π– , δ- и еще более сложные связи. При наложении π– связи на σ- связь образуется двойная связь, например в молекулах кислорода, этилена, диоксида углерода.
При наложении двух π– связей на σ- связь возникает тройная связь, например в молекулах азота, ацетилена и оксида углерода. Число связей между атомами в методе ВС называется кратностью связи.
π-связи в молекулах или ионах, у которых возможно несколько способов локализации связей между атомами, называются делокализованными связями.
2.3.6.
Пространственная конфигурация молекул
Если на внешней оболочке атома имеются два электрона, один в s- состоянии а другой в р- состоянии, то при затрате некоторой энергии вместо исходных s- и р- орбиталей могут образоваться две гибридные sp- орбитали (рис. 9). Они вытянуты вдоль прямой в противоположных направлениях.
 Благодаря
вытянутой форме гибридных
орбиталей, достигается более полное перекрывание взаимодействующих электронных
облаков, а значит, образуются более прочные химические связи. Энергия,
выделяющаяся при образовании этих связей больше, чем суммарные затраты энергии
на возбуждение атома и гибридизацию его атомных орбиталей. Т.к. sp- орбитали
ориентированы в противоположных направлениях, то структура молекулы линейная и валентный угол равен 180°. Связующее
электронное облако расположено симметрично между атомами и молекула является
неполярной, в тоже время связь в молекуле всегда обладает направленностью и
является полярной. Такую пространственную конфигурацию будут иметь молекулы
элементов II группы: MgBr2, СаН2, ВаF2.
Благодаря
вытянутой форме гибридных
орбиталей, достигается более полное перекрывание взаимодействующих электронных
облаков, а значит, образуются более прочные химические связи. Энергия,
выделяющаяся при образовании этих связей больше, чем суммарные затраты энергии
на возбуждение атома и гибридизацию его атомных орбиталей. Т.к. sp- орбитали
ориентированы в противоположных направлениях, то структура молекулы линейная и валентный угол равен 180°. Связующее
электронное облако расположено симметрично между атомами и молекула является
неполярной, в тоже время связь в молекуле всегда обладает направленностью и
является полярной. Такую пространственную конфигурацию будут иметь молекулы
элементов II группы: MgBr2, СаН2, ВаF2.
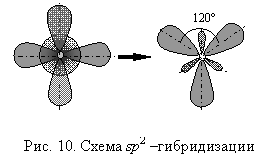

Рассмотрим пространственную структуру молекул элементов III группы. Химическая связь
образуется за счет s–электрона и двух p–электронов внешнего энергетического
уровня. Возникающее явление sp2–гибридизации, приводит к образованию
трех равноценных гибридных орбиталей, ориентированных в пространстве под углом
120° (рис. 10). Все три связи равноценны
и имеют направление к более электроотрицательному элементу. Образуемые
элементами III группы молекулы имеют структуру плоского треугольника.
Дипольный момент таких молекул равен 0 и молекула неполярна. Валентный угол составляет 120°.
Аналогичные структуры у молекул GaCl3,
InBr3, TeI3.
При образовании молекул элементами IV группы главной подгруппы валентные электроны подвергаются sp3–гибридизации (рис. 11). Гибридная орбиталь способна к более сильному перекрыванию с орбиталями других атомов и образованию более прочных связей. Гибридные орбитали расположены в пространстве под углом 109°28’ и направлены к вершинам тетраэдра. Аналогичное строение имеют молекулы SiCl4, GeF4 СН4 и т. п.
 Молекулы
элементов V группы главной подгруппы NH3,
PH3, AsH3
используют для связей три неспаренных р–электрона,
находящихся на взаимно перпендикулярных орбиталях. Но результаты
экспериментальных измерений показывают, что угол между связями в молекуле NH3 отличен от 90° и составляет
108° (рис. 12).
Полагают, что имеет место sp3–гибридизация
и из четырех гибридных орбиталей одна занята неподеленной электронной парой.
Она влияет на связующие электронные пары, отталкивая их и угол отличается от
тетраэдрического (109°). Молекулы имеют структуру тригональной пирамиды.
Молекула является полярной.
Молекулы
элементов V группы главной подгруппы NH3,
PH3, AsH3
используют для связей три неспаренных р–электрона,
находящихся на взаимно перпендикулярных орбиталях. Но результаты
экспериментальных измерений показывают, что угол между связями в молекуле NH3 отличен от 90° и составляет
108° (рис. 12).
Полагают, что имеет место sp3–гибридизация
и из четырех гибридных орбиталей одна занята неподеленной электронной парой.
Она влияет на связующие электронные пары, отталкивая их и угол отличается от
тетраэдрического (109°). Молекулы имеют структуру тригональной пирамиды.
Молекула является полярной.
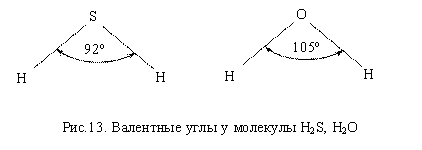
Молекулы элементов VI группы имеют угловую пространственную структуру, что
обусловлено наличием двух неспаренных р–электронов,
участвующих в образовании химических связей. Валентный угол у таких молекул
составляет примерно 90°. Отклонения валентного угла от 90° объясняют эффектом
взаимного отталкивания неподеленных пар электронов. Образуются полярные
молекулы, так как результирующая векторов связей отлична от нуля (рис. 13).
Химическая
связь, образованная положительно заряженным водородом молекулы (или полярной
группы) и электроотрицательным атомом другой или той же молекулы, называется водородной связью.
Если водородная связь образуется между разными молекулами, она называется межмолекулярной, если связь образуется между двумя группами одной и той же молекулы, то она называется внутримолекулярной. Водородная связь между молекулами А–Н и В–R обозначается тремя точками ···.
А–Н + В–R = А–Н ··· В–R
водород в данном случае образует две химические связи, причем они не равноценны.
Образование водородной связи обусловлено тем, что в полярных молекулах А – Н или полярных группах –А – Н поляризованный атом водорода обладает уникальными свойствами: отсутствием внутренних электронных оболочек, значительным сдвигом электронной пары к атому с малым размером. Поэтому водород способен глубоко внедряться в электронную оболочку соседнего отрицательно поляризованного атома.
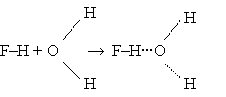
Атомы могут быть одинаковыми, как при взаимодействии НF
Fδ‾–Нδ+ + Fδ‾–Нδ+ = F–Н···F–Н,
но могут быть и разными, как при взаимодействии воды и фтороводорода
2.4.1. Энергия и
длина водородной связи
Энергия водородной связи возрастает с увеличением электроотрицательности (ЭО) и уменьшением размеров атомов В. Поэтому наиболее прочные водородные связи возникают, когда в качестве атомов В выступают F, О или N. Энергия связи (кДж/моль) возрастает в ряду
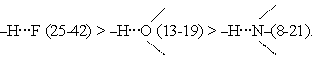
Несмотря на высокую ЭО у хлора, водородная связь –Н···Cl– относительно слабая из-за большого размера атома хлора
2.4.2. Влияние
водородных связей на свойства веществ
При возникновении водородных связей образуются димеры, тримеры или полимерные структуры, например зигзагообразные структуры (НF)n, кольцевые структуры некоторых органических кислот, например уксусной кислоты, или более сложные конфигурации, например у льда, у которого молекулы воды образуют по четыре водородные связи. Соответственно в жидком состоянии молекулы, вступающие в водородные связи, ассоциированы, а в твердом состоянии образуют сложные кристаллические структуры.
Образование межмолекулярных водородных связей приводит к существенному изменению свойств веществ: повышению вязкости, диэлектрической постоянной, температур плавления и кипения, теплот парообразования и плавления. Например, вода, фтороводород и аммиак имеют аномально высокие температуры кипения и плавления. Под влиянием водородных связей изменяются и химические свойства.
2.4.3. Значение
водородных связей
Так как многие соединения содержат ковалентные полярные связи Н–О и Н–N, то водородные связи очень распространены. Они проявляются не только в воде, но и в различных кристаллических веществах, полимерах, белках, живых организмах. Например, практически все соли образуют кристаллогидраты, в которых имеются водородные связи. Вследствие невысоких значений энергии водородные связи относительно легко разрушаются и вновь возникают.
Важную роль водородные связи играют в белках, у которых спиральные полимерные структуры объединяются связями N–H···O. Двойные спирали нуклеиновых кислот соединяются межмолекулярными водородными связями N–Н···N и N–H···О.
Итак, между полярными молекулами, содержащими в одной или обеих молекулах атом водорода, возникают водородные связи, которые существенно влияют на свойства вещества.