4. ПОЛУПРОВОДНИКОВЫЕ
МАТЕРИАЛЫ
К полупроводниковым материалам или
полупроводникам относится группа веществ с шириной запрещенной зоны менее
3,5 эВ, обладающих электронной и дырочной электропроводностью. Полупроводниковые
материалы используют для изготовления: выпрямителей, усилителей и генераторов,
преобразователей энергии (солнечные батареи и др.) нагревательных элементов,
датчиков давления и температуры; регуляторов тока и напряжения, элементов
памяти в ЭВМ и т.д..
Полупроводниковые материалы подразделяются на:
·
химические элементы (простые или элементарные
полупроводники),
·
химические соединения (сложные полупроводники),
·
аморфные полупроводники,
·
органические полупроводники.
В периодической системе элементов содержится 13 элементов,
обладающих полупроводниковыми свойствами.
Химические элементы – полупроводники в периодической системе
элементов
|
IA |
IIA |
IIIA |
ΔW, эВ |
IVA |
ΔW, эВ |
VA |
ΔW, эВ |
VIA |
ΔW, эВ |
VIIA |
ΔW, эВ |
VIII |
|
Металлы |
B |
1,1 |
C |
5,5 |
P |
1,5 |
S |
2,5 |
|
|
|
|
|
|
|
Si |
1,1 |
As |
1,2 |
Se |
1,7 |
|
|
|
||
|
|
|
Ge |
0,72 |
Sb |
|
Te |
0,36 |
I |
1,25 |
|
||
|
|
|
a-Sn |
0,08 |
Bi |
|
|
|
|
|
|
||
ΔW – ширина
запрещенной зоны элемента.
4.1.1. Полупроводники III группы
III группа содержит один
полупроводниковый элемент – бор (5В), обладающий
электронной структурой – 1s22s22p1.
Главные природные
соединения бора – борная кислота Н3ВО3 и соли борных кислот, из которых наиболее известна бура – Na2B4O7·10H2O.
По химическим свойствам
бор сходен не с элементами III группы, а с элементом IV группы – кремнием. В
этом проявляется "диагональное сходство". Бор, как и кремний,
образует слабые кислоты, не проявляющие амфотерных
свойств, тогда как Аl(ОН)3
– амфотерное основание.
Соединения бора и
кремния с водородом – летучие вещества, самовоспламеняющиеся на воздухе. Как и
кремний, бор образует соединения с металлами с большой твердостью и высокими
температурами плавления.
Кристаллы бора
получают пиролизом диборана В6Н6
на вольфрамовой проволоке или
восстановлением ВВr3 водородом в контакте с горячей танталовой проволокой.
Электрические свойства бора зависят от температуры пиролиза.
При обычных условиях
бор находится в твердом виде, образуя макромолекулы (В12) с ковалентными связями. Удельное сопротивление бора ρ
= 0,02 Ом·м, ширина запрещенной
зоны – 1,08 эВ. Подвижность[1] дырок больше подвижности
электронов. Подвижность дырок 0,2÷50 см2/(В·с). Подвижность
электронов 0,4 ¸ 1,0 см2/(В·с).
Тонкие слои бора,
полученные пиролизом, применяют для изготовления стабильных резисторов.
4.1.2.
Полупроводники IV группы
Это алмаз, кремний,
германий, серое олово (a - Sn)
и система твердых растворов германия и кремния. Кристаллическая структура
полупроводников алмазоподобная.
В элементарной ячейке
этих веществ содержатся 8 атомов. Весь кристалл можно рассматривать как
огромную молекулу, в которой атомы связаны ковалентной связью.
В нормальном
состоянии элементы имеют электронную формулу s2р2.
Атом может образовать две ковалентные связи. В возбужденном состоянии – s1р3. Все р- орбитали заняты. Поэтому вещества являются типичными
полупроводниками, с заполненной в невозбужденном состоянии валентной зоной.
Алмаз
Атомы углерода
находятся в состоянии sр3 – гибридизации и образуют трехмерную тетраэдрическую сетку,
в которой они связаны друг с другом ковалентными связями. Расстояние между
атомами в тетраэдрах равно 0,154 нм
(1нм=10-9м). Структура
решетки – кубическая. Число атомов в элементарной решетке – 8.
Существуют несколько
разновидностей природных алмазов, отличающихся своими физическими свойствами:
алмазы типов I, II, III, в каждом из
которых выделяются подтипы. Чаще всего в природе встречаются алмазы типа I. Они
правильной формы и изотропны, имеют голубую флюоресценцию, непрозрачны для УФ –
лучей.
Среди алмазов типа II
очень редко встречаются алмазы типа IIб,
которые имеют проводимость р – типа,
удельное сопротивление, ρ =
0,50÷12 Ом·м. Алмазы применяют в качестве счетчиков a
и b - частиц и γ
- излучения.
Кремний
Наиболее распространенный элемент земной коры (до 28 % земной коры). Существует в аморфном и
кристаллическом состоянии. Свободный кремний можно получить прокаливанием
диоксида кремния с магнием
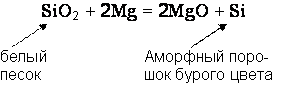
Полупроводниковыми
свойствами обладает кристаллический кремний высокой степени очистки. В
промышленности кремний получают восстановлением SiО2 коксом в электрических печах:
SiO2
+ 2C = Si + 2CO.
Полученный кремний
содержит 2 - 5%
примесей.
Диоксид кремния или
кремнезем (SiO2) встречается в кристаллическом и аморфном виде. В природе
находится в виде минерала кварца, прозрачные, бесцветные кристаллы которого в
форме шестигранных призм, называют горным хрусталем. Горный хрусталь,
окрашенный примесями в лиловый цвет, называется аметистом, а в буроватый –
дымчатым топазом. Разновидности кварца – агат и яшма. Из мелких зерен кварца
состоит обычный песок. Чистый кварцевый песок – белого цвета, но чаще он
окрашен соединениями железа в желтый или красноватый цвет.
Чистый кремний
получают зонной плавкой и термическим разложением иодида кремния SiJ4, силана SiН4, или SiСl4.
Кремний высокочистый
имеет тетраэдрическую структуру (sр3
– гибридизация) расположения атомов
и кубическую форму решетки, как у алмаза. Каждый атом кремния соединен четырьмя
валентными связями с расположенными в вершинах тетраэдра другими атомами.
Собственная проводимость кремния
определяется термической генерацией собственных носителей заряда – электронов и
дырок, при переходе электронов из валентной зоны в зону проводимости. Концентрация
носителей экспоненциально зависит от температуры.
Дырочная проводимость достигается
введением акцепторов, т.е. элементов III группы – Аl или В. Электронная
проводимость – введением доноров элементов V группы – Аs или Sb.
Германий
Четырехвалентный элемент,
имеющий структурный тип решетки алмаза. Дефицитнее кремния. Получают из GеО2 восстановлением водородом:

Порошок сплавляется в
кварцевой лодочке. Затем слиток подвергается зонной очистке. После очистки из
германия готовят монокристаллы из расплава.
Свойства германия и кремния
|
|
Gе |
Si |
|
Плотность, 103 кг/м3 |
5,3 |
2,3 |
|
Температура плавления, °С |
936 |
1414 |
|
Удельное сопротивление, ом·м |
0,68 |
2000 |
|
Ширина запрещенной зоны, эВ |
0,72 |
1,12 |
|
Подвижность электронов, см2/(В·с) |
3900 |
1400 |
|
Подвижность дырок, см2/(В·с) |
1900 |
500 |
Германий применяется
для изготовления диодов и триодов, датчиков Холла для измерения напряженности
магнитного поля, фототранзисторов и фоторезисторов.
Олово (α - Sn)
Серое олово
α – Sn
обладает полупроводниковыми
свойствами, имеет кристаллическую решетку типа алмаза. Белое олово β – Sn
превращается в серое α – Sn области температур -10 ÷ -30°С в результате фазового
перехода, скорость которого увеличивается с повышением чистоты олова. При
фазовом переходе меняется плотность олова с 7,3 г/см3 до 5,8 г/см3.
Поэтому при переходе из β–
в α- модификацию олово превращается в серый порошок (оловянная чума).
Ширина запрещенной зоны α – Sn равна 0,082 эВ. Малая энергия активации и
высокая подвижность носителей тока (электронов и дырок) являются причинами
высокой электропроводности α – Sn –
2,5·105 Ом-1·м-1.
Основной природный
минерал, из которого получают восстановлением олово, касситерит SnО2. Мировое производство – 105 тонн/год. Если темпы
потребления не снизятся, то через 50 лет основные запасы его будут
исчерпаны.
Олово растворяется в
кислотах:
Sn + H2SO4 →SnSO4+H2↑
в щелочах:
Sn + 2NaOH + 2H2O →
Na2[Sn(OH)4] + H2↑,
что указывает на его
амфотерность. Олово устойчиво на воздухе, поэтому используется для покрытий
стальных изделий от коррозии.
Полупроводниковыми свойствами обладают фосфор (P) - неметалл, мышьяк (Аs), сурьма (Sb) - полуметаллы, висмут (Вi) – металл.
Электронное состояние
этих элементов – ns2 np3 .
As
и Sb – токсичны, особенно аран (АsН3) и стибан
(SbН3).
Фосфор
Существует в
модификациях: белый, красный, черный. Белый фосфор с молекулярной структурой самая
неустойчивая форма фосфора.
Красный фосфор –
полимер белого. Черный фосфор – получается при нагревании белого до 200 °C под давлением или
красного до 350 °C под давлением, имеет слоистую структуру как у
графита.
Ширина запрещенной
зоны белого фосфора 2,6 эВ, красного фосфора 1,56 эВ, черного фосфора – 0,33 эВ.
Под давлением у
фосфора ширина запрещенной зоны уменьшается. Структура черного фосфора анизотропна и его электрические свойства сильно зависят от
направления.
Все модификации
обнаруживают фотопроводимость. В качестве компонента фосфор входит в полупроводниковые
химические соединения.
Мышьяк
Известны три модификации мышьяка: красный, состоящий из тетраэдрических
молекул – Аs4, черный – стеклообразный Аs – полимер, подобный черному фосфору, серый Аs – устойчивая
модификация, получаемая при нагреве черного Аs.
Полупроводниковыми
свойствами обладает только серый кристаллический Аs. В чистом виде не применяется, только как компонент в
соединениях.
Это сера (S), селен (Sе), теллур (Те).
Ярко выраженными полупроводниковыми свойствами обладают Sе и Те, имеющие сходство. Их атомы имеют электронную конфигурацию ns2np4. Ковалентная химическая связь осуществляется двумя неспаренными р-электронами
атомов. Благодаря этим связям образуются либо двухатомные молекулы с двойной
связью, либо многоатомные кольцевые молекулы из 8 атомов. Кольцевые молекулы
могут полимеризоваться в длинные цепи больших
молекул.
Моноклинный Sе, являющийся диэлектриком, состоит из колец двух типов:
гофрированных колец Sе8 и многочленных колец, состоящих из нескольких сотен до
тысячи атомов. При нагреве кольца распадаются на цепочки, которые полимеризуются в длинные зигзагообразные винтовые цепи.
Поэтому такую модификацию можно рассматривать как высокополимерное вещество.
У Те
больше атомная масса и объем, и химические связи слабее, чем у Sе, поэтому Те начинает кристаллизоваться
при комнатной температуре и скорость возрастает с ростом температуры. При
120 °С кристаллизация завершается за 1 час, а при 80 – за 15 дней. Примеси
фосфора и мышьяка замедляют ее.
Наибольшее значение
как полупроводниковые материалы имеют гексагональные формы селена Sе и теллура Те. Они образуют ряд
твердых растворов, с длинными цепями молекул, а сплавы их представляют смесь
полимерных молекул.
Селен
Аморфная и
моноклинная (красная) модификация селена, а также жидкий селен, состоящий из
смеси линейных и кольцевых молекул, обладают высоким удельным сопротивлением ρ = 1011 Ом·м. Селен – полупроводник р-типа. Носители зарядов – дырки, при повышении температуры их
концентрация не меняется, но проводимость селена растет, что обусловлено
увеличением подвижности дырок. В жидком состоянии электропроводность у селена
остается дырочной. При введении примесей электропроводность селена изменяется.
Это используют при производстве селеновых выпрямителей путем введения примесей
галоидов. Ширина запрещенной зоны у гексагонального селена ∆W. =
1,7÷1,9 эВ, а у аморфного ∆W
= 4,6 эВ.
Селен используют в
полупроводниковой технике, как в элементарном виде, так и в композициях (РbSе, СdSе, Вi2Sе3 и др.). Применяется селен в фоторезисторах, в элементах фотоэ.д.с., в селеновых выпрямителях переменного
тока.
Теллур
Теллур полупроводник с дырочной проводимостью, сохраняющий
свойства полупроводника в жидком состоянии, а с ростом температуры
электропроводность переходит в металлическую.
Используется для
изготовления полупроводниковых сплавов со свинцом, висмутом и сурьмой, обладающих
большой термо – э.д.с. и
являющихся основой для термоэлектрических генераторов.
4.2.Полупроводниковые химические соединения
Полупроводники типа АIII BV
Это химические
соединения, образующиеся при взаимодействии элементов АIII и BV
подгрупп периодической системы Менделеева.
Эти соединения характеризуются наличием у АIII
на внешних оболочках
по 3 валентных электрона – s2р1,
а у ВV
– 5 валентных
электронов в состоянии s2р3.
На каждый атом приходится – 4 электрона, как в элементах IV группы, а отсюда и
одинаковые кристаллические структуры и электронные свойства этих соединений с
алмазом, кремнием, германием и другими элементами IV группы. Но отличаются
типом связи – наряду с ковалентной есть и ионные, т.к. в узлах решетки
располагаются положительные и отрицательные ионы.
Кристаллическая
решетка соединений типа АIII ВV менее
симметрична, чем решетка алмаза, германия, кремния. Примерами соединений этого
типа могут быть: InSb
– антимонид индия, InАs
– арсенид индия, InР – фосфид
индия, GаSb – антимонид
галлия, GаАs – арсенид галлия,
GаР – фосфид галлия, АlSb – антимонид алюминия.
Эти соединения имеют
большую, чем у германия и кремния подвижность электронов. Электропроводность
полупроводниковых соединений зависит от примесей, входящих в междоузлия или в
узлы атомной решетки в виде атомов замещения (это элементы II, IV, VI
групп).
Арсениды, антимониды
и фосфиды индия и галлия получают сплавлением компонентов в вакууме в кварцевых
ампулах. Выращивание кристаллов этих соединений – например, GаАs методом Чохральского, такое же
как Gе и Si, но с
магнитным управлением, с направленной кристаллизацией. Можно использовать
зонную плавку.
Карбид кремния SiC (AIV BIV)
Получается
восстановлением из SiО2 углем при высокой температуре в электрических печах:
SiO2 + 3C = SiC + 2CO.
Примеси удаляют
добавлением NаСl, образующиеся
хлориды улетучиваются при высокой температуре. Чистый карбид кремния бесцветен.
Величина проводимости и тип зависит от примесей. Удельное сопротивление чистого
карбида кремния 1011Ом·м, с примесями - 0,001 Ом·м.
Химическая структура
и тип связи у карбида кремния такой же как у элементов IVВ подгруппы. Имеется
ряд модификаций карбида кремния. Ширина запрещенной зоны карбида кремния – 2,86
эВ.
Примесь элементов V
группы (P, As,
Sb, Bi) и железа в карбиде кремния дает зеленую окраску и
проводимость n – типа (электронную).
Примесь элементов II
группы (Са, Мg) и III группы (В, Аl, Gа, In) дает голубую окраску и проводимость р
– типа. Избыток кремния в карбиде кремния дает проводимость n – типа, а избыток С – р
–проводимость.
Карбид кремния
применяют для нелинейных резисторов, термокомпенсаторов,
силовых выпрямителей с р-n- переходом,
работающих при высоких температурах (до 650 °С).
Оксиды
Из оксидов наибольшее
применение получила закись меди Сu2О, обладающая
ширной запрещенной зоны ∆W
= 0,22÷0,39 эВ. Является
основой медно – закисных (купроксных) выпрямителей.
Медные пластины нагревают при 1020÷1040 °С в окислительной среде
5 мин, затем переносят в печь с температурой 600°С, где выдерживают 10
мин. Получается в итоге двойное покрытие: первое Сu2О (закись), второе СuО – окись. Закись меди Сu2О – полупроводник, а СuО – диэлектрик. Окись меди в требуемых местах вытравливают. Сu2О
является примесным полупроводником n
– типа, с интервалом рабочих температур от –40 до +60°С. Медное основание в
прилегающей к пленке Сu2О
имеет электронную проводимость, что обусловливает в слое закиси меди электронно – дырочный переход.
Меднозакисные выпрямители широко применялись в технике (в измерительных
приборах, в схемах автоматических устройств и др.).
Мn3О4 – закись – окись марганца – поликристаллический
полупроводник с ∆W
= 1,25 эВ. Этот окисный
полупроводник применяется в термисторах (термометрах сопротивления).
К оксидным полупроводникам
с электронной электропроводностью относятся широко используемые
радиоэлектронике ферриты и сегнетоэлектрики (сегнетова соль).
Полупроводниковые
свойства проявляют те оксиды, у которых один или более ионов металла относится
к элементу переходного ряда (Ti, Cu, Zn, Ni, Co, Fe, Mn, Cr, V).
Сульфиды (люминофоры)
В полупроводниковой технике применяют: сульфид свинца РbS; сульфид цинка ZnS; сульфид
кадмия СdS; сульфид висмута Вi2S3.
Сульфид свинца имеет кристаллическую структуру с кубической решеткой.
Плотность – 7,5·103
кг/м3, молекулярная масса – 239, температура плавления 1114 °С,
∆W = 0,4 эВ. В зависимости от соотношения S
и Рb получается проводимость: дырочная – если больше серы,
электронная – если больше свинца, подвижность электронов 80 см2/(В·с).
Сульфид свинца применяется для термоэлементов и фоторезисторов с высокой
чувствительностью в ИК области спектра.
Сульфид цинка – кристаллическая структура с кубической или гексагональной
решеткой природного или синтетического происхождения.
Сульфид кадмия – полупроводниковый кристаллический материал гексагональной
структуры, молекулярная масса – 144,5; плотность – 4,82·103 кг/м3, ∆W = 2,1 эВ. Применяют
для фоторезисторов.
Сульфид висмута – кристаллическое вещество ромбической структуры, получают
сплавлением висмута с серой в нейтральной среде или в вакууме. Плотность – 7,4·103 кг/м3; молекулярная масса – 514,2;
∆W = 1,25 эВ.
Cоединения типа АIIВVI
Селениды
Наибольшее применение
получили CdSe, PbSe, HgSe.
Селенид ртути НgSе – кристаллическое
вещество, получают сплавлением компонентов в вакууме при 960 °С; имеет
электронную проводимость с подвижностью электронов 5000 см2/(В·с), ∆W = 0,3 эВ.
Применяется в датчиках э.д.с. Холла, фоторезисторах,
лазерах.
Физические свойства соединений типа АIIВVI
|
|
CdS |
CdSe |
CdTe |
PbS |
PbSe |
PbTe |
|
Молекулярная масса |
72,0 |
95,0 |
120,5 |
120,0 |
143,0 |
168,0 |
|
Температура плавления,°С |
1475 |
1250 |
1040 |
1110 |
1065 |
904 |
|
Ширина запрещенной
зоны ∆W, эВ |
2,4 |
1,8 |
1,5 |
0,6 |
0,55 |
0,6 |
|
Подвижность, см2/(В·с) |
|
|
|
|
|
|
|
электронов |
200 |
200 |
600 |
600 |
900 |
300 |
|
дырок |
20 |
- |
50 |
400 |
500 |
300 |
Теллуриды
Из полупроводниковых соединений
теллура в ИК – технике используют теллурид свинца РbТе, теллурид кадмия СdТе, теллурид висмута Вi2Те3.
РbТе,
обладающий высокой чувствительностью к ИК – излучению, в виде теллуристо – свинцового фоторезистора используется как приемник
ИК – излучения.
Органические полупроводники
Органические
полупроводники – это органические соединения с сопряженными связями:
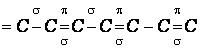
то есть, есть
электроны общего пользования, значит, молекула обладает свойствами металла и к
ней можно применить зонную теорию в одномерном приближении. Дискретные уровни p электронов представляют собой валентную зону. Энергия
активации электронов – запрещенную зону. Проводимость внутри молекулы очень
велика, т. к. p электроны
обладают высокой подвижностью и небольшой энергией возбуждения.
Так жидкий бензол –
диэлектрик, так как электронам трудно преодолеть энергетический барьер, связанный
с межмолекулярными взаимодействиями. Если соединить молекулы бензола определенным
образом, то энергетический барьер можно понизить, и соединение может быть полупроводником.
Аморфные полупроводники
К аморфным
(стеклообразным) полупроводникам относятся селениды, теллуриды,
сульфиды элементов V группы периодической
системы, образующие соединения с аморфной структурой:
Sb2Te3,
As2S3,
As2Se3,
As2Se5.
Для них характерен
ближний порядок и зонная теория не применима. Свойства можно объяснить на
основе теории валентной связи. Их проводимость мало зависит от примесей, а зависит
от размеров атомов, образующих соединения. С уменьшением радиуса атома
полупроводниковые свойства переходят в диэлектрические.