Лабораторная работа № 9
КОМПЛЕКСНЫЕ СОЕДИНЕНИЯ
Цель работы: изучение явлений комплексообразования, свойств различных комплексов.
1. ТЕОРЕТИЧЕСКОЕ ВВЕДЕНИЕ
Комплексными
соединениями называют определенные
молекулярные соединения, при сочетании компонентов которых образуются
положительно или отрицательно заряженные
сложные ионы, способные существовать как в кристалле,
так и в растворе (А. Гриндберг), например: K3[Fe(CN)6].
В
комплексном соединении выделяют внешнюю (3К+) и внутреннюю ([Fe(CN)6]
сферы.
Внутренняя сфера состоит из центрального
атома (комплексообразователя), вокруг которого группируются ионы или молекулы.
В приведенном примере ион Fe3+ - комплексообразователь,
ионы CN- – лиганды. Число лигандов
в комплексе называется координационным числом комплексообразователя (к.ч.6). Заряд
комплекса численно равен суммарному заряду внешней сферы и противоположен ему
по знаку. В нашем примере во внешней сфере комплексного соединения ([Fe(CN)6]
находятся три иона К+. Следовательно, заряд
комплексного иона равен - 3.
Заряд комплексообразователя
равен и противоположен по знаку алгебраической сумме всех остальных ионов (Fe3+).
Различают катионные,
анионные и нейтральные комплексы.
Комплекс с положительным
зарядом называется катионным. Например: [Cu(NH3)4]2+,
с отрицательным зарядом – анионным, например: [Cd(CN)4]2-,
с нулевым зарядом – нейтральным, например: Fe(CO)5.
Комплексообразователями,
как правило, являются атомы или чаще ионы металлов. Способность элементов к комплексообразованию возрастает от периода к периоду. В основном
это d-элементы.
Лигандами могут служить:
а) анионы кислот (ацидокомплексы) – F-, Cl-,
Br-, I-, CN-, NO2-, SO42-, PO43-, CO32-, SCN-;
б) гидроксогруппы ОН- (гидроксокомплексы);
в) нейтральные молекулы – Н2О
(аквокомплексы), NH3 (аммиакаты), СО (карбонильные), NO, F2, N2H4 и др.
В названия комплексов входят названия как лигандов, так и
комплексообразователей, причем вначале
указываются лиганды, а затем
комплексообразователи.
К анионным лигандам добавляют окончание – о. СО32- – карбонато,
CN – циано, N3- – азидо, ОН- -
гидроксо, О2- - оксо,
SCN – родано, SO32- - сульфито
и т.д.
Нейтральные молекулы имеют
те же названия, что и молекулы, за
исключением Н2О (акво), NH3
(аммин), СО (карбонил).
Названия комплексообразователей суффикс – ат (феррат, никелат,
хромат).
Число лигандов в комплексе обозначают греческими приставками (ди, три, тетра, пента и т.д.)
Для металлов с переменной
валентностью степень окисления указывается в скобках.
Пример:
[Zn(NH3)4]Cl2 – дихлортетрааммин цинка
K3[Fe(CN)6]
– гексацианоферрат (III) калия
[Ni(CO)4]
- тетракарбонилникель
(0)
Комплексные соединения являются сильными
электролитами, т.е. при растворении полностью диссоциируют на комплексные ионы (внутреннюю сферу) и противоионы
(внешнюю сферу):
[Ni(NH3)6]Cl2
⇄ [Ni(NH3)6]2+
+ 2Cl-
Комплексные
ионы в растворах в свою очередь ведут себя как слабые электролиты и
диссоциируют не полностью, например:
[Ni(NH3)6]2+ ⇄ Ni2+ + 6NH3
Устойчивость комплексов можно
оценить с помощью закона действующих масс, выразив состояние равновесия с
помощью константы равновесия, называемой константой нестойкости.

Очевидно, чем устойчивее
комплекс, тем он в меньшей степени подвергается распаду и тем меньше его
константа нестойкости.
Об устойчивости комплекса
можно судить также по константе равновесия его
образования – так называемой константе
устойчивости Куст. Константа устойчивости Куст. – величина, обратная константе нестойкости Кнест.:
Кнест. = 1/Куст.
Для реакции образования иона [Ni(NH3)6]+2
в растворе
Ni2+ + 6NH3 ⇄ [Ni(NH3)6]+2
константа
устойчивости будет:
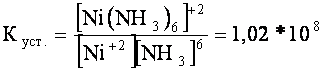
Константа устойчивости
является мерой комплексообразования – большей величине
константы устойчивости соответствует большая концентрация комплекса при
равновесии.
Сравнение константы
устойчивости комплексных ионов
[Ag(NO2)2]- [Ag(NH3)2]+ [Ag(S2O3)2]3- [Ag(CN)2]-
7,7*102 1,5*107 1*1013 1*1021
показывает, что наиболее
устойчивым из этих комплексов является последний, а наименее устойчивый –
первый.
Значения констант
нестойкости могут сильно колебаться, особенно для комплексных анионов. Если
значения Кнест.
комплексного аниона достаточно велики, то это означает, что по существу, мы
имеем вместо комплексной соли двойную соль.
Двойными солями называются продукты замещения атомов водорода в кислотах на два
различных катиона. В водных растворах двойные соли диссоциируют, образуя два
различных катиона и анионы одного вида
NaAl(SO4)2
= Na+ + Al3+ + 2SO42-
2. ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
ОПЫТ 1. АНИОННЫЙ КОМПЛЕКС
(ТЕТРАИОДОВИСМУТАТ КАЛИЯ)
В пробирку к 3-4 каплям раствора хлорида висмута прибавить по каплям
раствор иодида калия до выпадения темно-бурого осадка иодида висмута.
Растворить этот осадок в избытке раствора иодида калия.
Задание: Каков цвет полученного раствора? Может ли эта
окраска обусловливаться присутствием ионов К+,
I-, Bi3+? Какой из этих ионов может быть комплексообразователем? С какими лигандами он
мог образовать в данном растворе сложный ион? Ответ мотивировать.
Написать уравнения реакций: образования иодида
висмута с избытком иодида калия. Написать уравнение электролитической
диссоциации полученного комплексного соединения.
Опыт 2. Гидроксокомплексы
В три пробирки поместить раздельно растворы солей цинка, хрома (III), алюминия и в каждую из них добавить по каплям раствор
щелочи. Наблюдать вначале выпадение осадков, а затем их растворение в избытке
щелочи.
Задание: Написать уравнения реакций, учитывая, что образуются растворимые гидроксокомплексы, содержащие ионы
[Zn(OH)4]2-, [Cr(OH)6]3-. Зная, что гидроксиды цинка, хрома, алюминия растворяются также в
кислотах, указать, к какому типу они относятся.
Опыт 3. Катионный комплекс
Получить осадок гидроксида
никеля (II),
внеся в пробирку 3-4 капли раствора сульфата
никеля и такой объем раствора едкого натра.
К осадку добавить 5-6 капель раствора аммиака. Что происходит? Сравнить
окраску ионов Ni2+ в растворе сульфата
никеля с окраской полученного раствора. Присутствием
каких ионов обусловлена окраска раствора?
Задание: Написать уравнения реакций: образования гидроксида никеля (II), взаимодействия гидроксида
никеля с аммиаком и уравнение электролитической диссоциации образовавшегося комплексного основания
(координационное число никеля принять равным шести). Какое основание является
более сильным: простое или комплексное? Ответ обосновать.
ОПЫТ 4. КОМПЛЕКСНЫЕ СОЕДИНЕНИЯ В РЕАКЦИЯХ ОБМЕНА
В пробирку к 4-5
каплям раствора сульфата меди добавить такой же объем раствора комплексной соли
К4[Fe(CN)6]. Отметить цвет образовавшегося
осадка гексацианоферрата меди. Написать молекулярное и ионное уравнение реакций.
ОПЫТ 5. ДВОЙНЫЕ СОЛИ
В пробирке растворить двойную соль (NH4)2SO4*FeSO4*6H2O (соль
Мора) и разделить на 3 пробирки. В первую пробирку добавить 5-6 капель
раствора сульфид натрия, во вторую -
раствор хлорида бария. Выпавший черный осадок представляет собой сульфид
железа (II).
Отметить цвет осадков и написать ионные уравнения реакций их образования. На присутствие каких ионов в растворе двойной соли указывают
эти реакции? В третью пробирку добавить 7-8 капель 2н раствора гидроксида натрия и нагреть на водяной бане. подержать над пробиркой
лакмусовую бумажку, смоченную водой. По изменению окраски лакмуса и по запаху
определить, какой газ выделяется. Написать ионные уравнения реакции. На присутствие каких
ионов в растворе двойной соли указывает эта реакция? Учитывая результаты опыта,
написать уравнение электролитической диссоциации соли Мора. Проверить действие
раствора сульфида аммония обнаруживаются ли ионы Fe2+ в растворе K4[Fe(CN)6] Наблюдается ли выпадение черного
осадка FeS?
Задание:
Описать наблюдаемые явления. Ответить на вопросы и написать уравнения реакций.
Написать уравнение электролитической диссоциации K4[Fe(CN)6]. Чем
отличается электролитическая диссоциация двойной соли от диссоциации соли,
содержащей устойчивый комплексный ион?