Лабораторная работа № 8
ГИДРОЛИЗ СОЛЕЙ
Цель работы: исследование процесса гидролиза солей и установление факторов,
влияющих на гидролиз.
1.
ТЕОРЕТИЧЕСКОЕ ВВЕДЕНИЕ
При растворении некоторых
солей в воде нарушается равновесие диссоциации воды. Это является результатом
обменных реакций растворенного вещества с растворителем, приводящих к образованию
труднорастворимых, газообразных и малодиссоциирующих
соединений. Такое обменное взаимодействие растворенного вещества с водой
называется гидролизом.
В зависимости от природы растворенного вещества, его
гидролиз может происходить по-разному. Так если соль образована сильной
кислотой и основанием равной силы, то она полностью распадается в воде на свои
составные части, а ее катионы и анионы, сталкиваясь с ионами Н+ и ОН- , практически ими не связываются. Происходит
это по тому, что получающиеся в результате такого столкновения сильные кислота
и основание, вновь моментально распадаются на ионы. Поэтому равновесие электролитической
диссоциации воды не смещается, концентрация ионов
водорода и гидроксида остается постоянной, равной 10-7моль/литр.
Гидролизу подвергаются все
остальные соли:
·
образованные катионом сольного основания и анионом
слабой кислоты – происходит гидролиз по аниону;
·
образованные катионом слабого основания и анионом
сильной кислоты – происходит гидролиз по катиону;
·
образованные катионом слабого основания и анионом
слабой кислоты – происходит гидролиз и по катиону и по аниону.
Процесс гидролиза количественно характеризуется
степенью гидролиза (h) и
константой гидролиза (Кг).
Степенью гидролиза называется отношение числа молекул, подвергшихся гидролизу (Сгидр.),
к общему числу растворенных молекул (Собщ.):
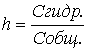
Степень гидролиза зависит от следующих факторов:
1. природы соли;
2. ее концентрации;
3. температуры раствора.
Разбавление раствора
равноценно увеличению концентрации одного из реагирующих веществ (воды) и
приводит к усилению гидролиза. Гидролиз концентрированных растворов происходит
слабее. Процесс гидролиза эндотермичен, по этому с повышением температуры
протекает полнее. Следовательно при гидролизе соблюдается принцип Ле-Шателье. Константой гидролиза (Кг) называется
- отношение произведения концентрации продуктов гидролиза к концентрации
негидролизованной соли (определяется обычно по таблицам). Величина Кг,
в отличие от степени гидролиза, не зависит от концентрации раствора, поэтому является
более удобной характеристикой процесса. Обе величины связаны между собой
отношением аналогичным закону разбавления:
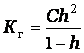
где С
– исходная концентрация соли в растворе, (моль/литр).
Если степень гидролиза мала (h << 1), то Кг
= h2*С,
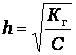
ПРИМЕР 1
Составьте молекулярное и ионно-молекулярное
уравнение гидролиза солей: а) NaCN , б) К2СО3
Решение:
а) Цианид натрия NaСN – соль
слабой одноосновной кислоты HCN и сильного основания NaOH. При растворении в воде молекулы NaCN полностью диссоциируют
на катионы Na+ и анионы CN . Катионы
Na+ не могут связывать ионы ОН-
воды , так как NaOH – сильный электролит .
Анионы же CN-связывают ионы Н+ воды , образуя молекулы
слабого электролита HCN . Соль гидролизуется ,
как говорят , по аниону. Ионно-молекулярное уравнение гидролиза:
CN- + H2O ⇄ HCN +
или
в молекулярной форме:
NaCN + H2O ⇄
HCN + NaOH
В результате гидролиза в растворе появляется
некоторый избыток ионов ОН-, поэтому
раствор NaCN имеет щелочную реакцию (рН > 7).
б) Карбонат калия K2CO3 – соль слабой многоосновной
кислоты и сильного основания. В этом случае
анионы соли СО32-, связывая водородные
ионы воды, образуют анионы кислой соли НСО3-, а не
молекулы Н2СО3. В обычных условиях гидролиз идет по первой ступени, соль гидролизуется по аниону. Ионно-молекулярное уравнение
гидролиза:
СО32-
+ НОН ⇄НСО3-
+ ОН-
или
в молекулярной форме:
К2СО3
+ Н2О ⇄ НСО3 + КОН
В растворе появляется избыток ионов ОН- ,поэтому раствор К2СО3
имеет щелочную реакцию рН>7.
ПРИМЕР 2
Составьте молекулярное и ионно-молекулярное уравнение реакции гидролиза соли CuCl2 .
Решение:
Хлорид меди – соль слабого многокислотного
основания Cu(OH)2 и сильной
кислоты HCl . В данном случае катионы Cu2+ связывают гидроксильные ионы воды, образуя катионы основной соли CuOH+. Образование молекул Сu(OH)2
не происходит, так как ионы CuOH+ диссоциируют гораздо треднее, чем молекулы
Cu(OH)2.
В обычных условиях гидролиз идет по первой
ступени.
Соль гидролизуется по
катиону. Ионно-молекулярное уравнение гидролиза:
Cu2+ + H2O ⇄
CuOH+ + H+
или
в молекулярной форме:
CuCl2 + H2O ⇄CuOHCl + HCl
В
растворе появляется избыток ионов водорода, поэтому раствор ZnCl2 имеет кислую реакцию (рН > 7) .
ПРИМЕР 3
Составьте молекулярное и ионно-молекулярное
уравнение реакции гидролиза соли Pb(CH3COO)2
.
Решение:
Ацетат свинца – соль слабого многокислотного
основания Pb(OH)2 и слабой одноосновной кислоты CH3COOH. В
данном случае параллельно протекают два процесса:
Pb+2 + H2O⇄PbOH+ + H+
СН3СОО- + Н2О⇄СН3СОО + ОН-
Ионно - молекулярное уравнение:
Pb2+ + СН3СОО- + Н2О ⇄ PbOH+ +
СН3СООН
или
в молекулярной форме:
Pb(СН3СОО)2
+ Н2О ⇄ PbOHСН3СОО + СН3СООН
Реакция раствора при этом зависит от относительной
силы кислоты и основания, образующих соль. Если Ккисл.
= Косн., то катион и анион гидролизуются в равной степени и реакция раствора будет нейтральной
(рН = 7). Если Ккисл.
> Косн., то катион соли гидролизуется в большей степени, чем анион, и концентрации ОН-
- ионов. В данном случае реакция раствора слабокислая. Наконец, если Ккисл. < Косн.,
то гидролизу преимущественно подвергается анион соли, и реакция раствора будет
слабощелочной.
ПРИМЕР 4.
Какие продукты образуются при смешивании растворов
солей Fe(NO3)3 и Na2CO3? Составьте
ионно-молекулярное и молекулярное уравнение реакции.
Решение: Соль Fe(NO3)3 гидролизуется по катиону, а Na2CO3 – по аниону.
Fe3+ + Н2О ⇄ FeОН2+ + Н+
CO32־ + Н2О ⇄ НСО־3-
+ ОН
Гидролиз
этих солей обычно ограничивается первой
ступенью. При смешивании растворов этих солей ионы Н+ и ОН־
взаимодействуют, образуя молекулы слабого электролита. Это приводит к тому, что
усиливается гидролиз каждой из солей до образования осадка и газа: Fe(ОН)3 и СО2
Ионно-молекулярное
уравнение
2 Fe+3 + 3CO32- + 3Н2О = 2Fe(ОН)2¯ + СО2
Молекулярное уравнение
2Fe(NO3)3 + 3Na2CO3
+ 3Н2О = 2Fe(ОН)2¯ + 3СО2 + 6Na NO3
Для воды и ее растворов произведение концентрации ионов Н+ и ОН-
величина постоянная при данной температуре и называется ионным
произведением воды Кв.
При 25оС Кв
= [H+] · [OH-]
= 1·10-14. Постоянство ионного произведения воды дает возможность
вычислить концентрацию одного вида ионов, если известна концентрация другого
вида ионов, а именно:
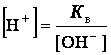
![]()
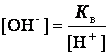
В чистой воде [H+] =
[OH-] = ![]() = 10-7
моль/л
= 10-7
моль/л
Концентрация ионов водорода
указывает на характер среды:
[H+] = [OH-] = 10-7 моль/л, нейтральная среда;
[H+] > 10-7 моль/л, кислая среда;
[H+] < 10-7 моль/л, щелочная среда.
Для удобства оценки
кислотности и щелочности среды пользуются не концентрацией водородных ионов, а
величиной водородного показателя рН, он равен
отрицательному десятичному логарифму концентрации водородных ионов рН = -lg[H+], следовательно, в щелочной
среде рН > 7; в нейтральной среде рН = 7,
в кислой среде рН < 7.
ПРИМЕР.
Вычислить
рН раствора, если
[H+] = 0,0001 = 10-4 моль/л.
Решение: [H+]= 0,0001 = 10-4
моль/л.
рН = -lg10-4 = 4; рН =
4
2. ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
ОПЫТ 1. РЕАКЦИЯ СРЕДЫ В
РАСТВОРАХ РАЗЛИЧНЫХ СОЛЕЙ.
В пять пробирок до 1/3 их объема налить
нейтральный раствор лакмуса. Одну пробирку оставить в качестве контрольной, а в
остальные добавить по одному микрошпателю кристаллов
следующих солей: в первую – хлорида алюминия, во вторую – карбоната натрия, в
третью – хлорида калия, в четвертую – ацетата аммония.
По изменению окраски лакмуса сделать вывод о
реакции среды в растворе каждой соли. Полученные результаты внести в таблицу.
Таблица 1.
Реакция среды в растворах солей
|
№ пробирки |
Формула соли |
Окраска лакмуса |
Реакция среды |
РН раствора рН<7 рН=7 рН>7 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Какие из исследованных солей подвергаются гидролизу? Написать ионные и
молекулярные уравнения реакций их гидролиза и указать вид гидролиза каждой соли
(простой или ступенчатый).
В случае ступенчатого гидролиза написать уравнение реакции только для
первой ступени, так как практически в достаточно концентрированных растворах
последующие ступени протекают очень слабо.
ОПЫТ 2. СЛУЧАИ ПОЛНОГО (НЕОБРАТИМОГО) ГИДРОЛИЗА СОЛЕЙ.
.
В две пробирки внести по 6-8 капель раствора
хлорида алюминия. В одну пробирку добавить такой же объем раствора сульфида натрия, в другую - раствора карбоната натрия. Отметить выделение
сероводорода в первой пробирке (по запаху) и пузырьков диоксида углерода во
второй. В обоих случаях в осадок выпадает гидроксид
алюминия.
Написать уравнения реакций, которые привели к
образованию гидроксида алюминия. Почему не получилось
сульфида и карбоната алюминия.
ОПЫТ 3. ВЛИЯНИЕ ТЕМПЕРАТУРЫ НА СТЕПЕНЬ ГИДРОЛИЗА СОЛИ.
В два стакана налить 1 М раствор ацетата натрия. Один стакан нагреть почти
до кипения раствора. Затем в оба стакана капнуть по 3-5 капель фенолфталеина.
Окраска появляется в стакане с горячим раствором, это указывает на усиление
гидролиза при нагревании.
ОПЫТ 4. ОПРЕДЕЛЕНИЕ РЕАКЦИИ
СРЕДЫ.
Для определения реакции среды
пользуются индикаторами – веществами, которые изменяют окраску в зависимости от
концентрации в растворе ионов Н+.
Индикаторы – слабодиссоциирующие органические
кислоты или основания, у которых недиссоциированные
молекулы и ионы благодаря разному строению имеют различную окраску.
Лакмус содержит так называемую азометиновую кислоту, недиссоциированные
молекулы которой красного цвета, а анионы – синего цвета.
Диссоциация лакмуса:
HInd
⇄ H+ +
красный синий
При растворении лакмуса в воде его молекулы HInd, присутствуя совместно с Ind-, придает раствору
промежуточную (фиолетовую) окраску.
Если к этому
прибавить кислоты, вследствие увеличения [H+] равновесие
диссоциации сместится влево – раствор
станет красным.
При добавлении к нейтральному раствору лакмуса [ОН-] равновесие
сместится вправо – раствор станет синим. Аналогично объясняется
изменение окраски у других индикаторов.
Определение рН раствора с
точностью = 0,02 рН проводят на приборе, называемом рН-метр.
Для получения достоверных данных необходимо точно соблюдать
правила работы на рН-метре.
Перед погружением в раствор электроды необходимо
каждый раз промывать дистиллированной водой и удалять остатки воды фильтровальной
бумагой. Правильность работы прибора проверяется по буферному раствору, рН которого известно и постоянно. Проверку проводит перед
измерением лаборант.
В сухой стаканчик залить анализируемый раствор и
погрузить в него электроды. Установить ручку термокомпенсатора
в положение, соответствующее комнатной температуре (20оС). Ручку «переключателя
рода работ» установить в положение рН, а кнопку
«выбора диапазонов» в положение «1-19». Отсчет показаний рН
производится после его установления, примерно в течение 3 минут по нижней
шкале. Для уточнения показания следует нажать кнопку одного из диапазонов измерения,
кроме «1-19». По окончании измерений промойте электроды и опустите их в
стаканчик с дистиллированной водой.