Лабораторная работа №3
ОПРЕДЕЛЕНИЕ ТЕПЛОВОГО ЭФФЕКТА
РЕАКЦИИ НЕЙТРАЛИЗАЦИИ
Цель работы – определение теплового
эффекта реакции нейтрализации сильной кислоты сильным основанием с использованием
калориметрической установки и проведение термодинамических расчетов.
1.
ТЕОРЕТИЧЕСКОЕ ВВЕДЕНИЕ
Химические реакции сопровождаются выделением или поглощением энергии (теплоты).
Первые называются экзотермическими,
вторые – эндотермическими.
Количество выделенной или поглощенной теплоты называют тепловым эффектом процесса (Q). Последний зависит от природы веществ, их количества,
агрегатного состояния и температуры процесса. Изучением тепловых эффектов
химических процессов занимается термохимия.
Большинство химических
процессов протекают при постоянном давлении (р = const), т.е. является изобарными.
Для изобарных процессов тепловой эффект равен разности энтальпий (![]() ) конечного и исходного состояния системы, характеризующей
«теплоспособность» системы:
) конечного и исходного состояния системы, характеризующей
«теплоспособность» системы:
![]()
Величина (![]() ) – энтальпия химической реакции - измеряется в кДж. Для экзотермических реакций (
) – энтальпия химической реакции - измеряется в кДж. Для экзотермических реакций (![]() ) < 0, для эндотермических - (
) < 0, для эндотермических - (![]() ) > 0. Изменение энтальпии (тепловой эффект
химической реакции), а также агрегатное состояние каждого из исходных веществ и
продуктов реакции указывают в термохимических
уравнениях. Кроме этого, в них допускается применение
дробных коэффициентов, так как тепловой эффект рассчитывается на один моль
вещества.
) > 0. Изменение энтальпии (тепловой эффект
химической реакции), а также агрегатное состояние каждого из исходных веществ и
продуктов реакции указывают в термохимических
уравнениях. Кроме этого, в них допускается применение
дробных коэффициентов, так как тепловой эффект рассчитывается на один моль
вещества.
Пример термохимического
уравнения:
(NH4)2Cr2O7(к) = N2(г) + Cr2O3(к) + 4H2O(ж); ![]() = -477 кДж.
= -477 кДж.
В данной записи (к), (г),
(ж) означают, соответственно, кристаллическое, газообразное и жидкое состояния.
Для термохимических расчетов
важна стандартная энтальпия образования соединений ΔНообр
– это тепловой
эффект реакции образования 1 моля этого соединения из простых
веществ, устойчивых при стандартных условиях (температура 298
К и давление 101,3 кПа).
Основным законом термохимии
является закон Г.И.Гесса, согласно которому
изменение энтальпии (внутренней энергии) в химической реакции определяется
только видом и состоянием исходных веществ и продуктов реакции и не зависит от
пути перехода от начальных веществ к конечным.
Следствием из закона Гесса
является соотношение:
![]()
Где ![]() – энтальпия химической
реакции.
– энтальпия химической
реакции.
Первый член в правой части уравнения – сумма энтальпий образования
продуктов реакции, взятых с учетом стехиометрических коэффициентов в уравнении
реакции;
Второй член – аналогичная
сумма для исходных веществ.
Известно, что нейтрализация 1 эквивалента любой сильной кислоты любым сильным основанием в разбавленных водных растворах сопровождается экзотермическим эффектом, при 298 К равным – 57,22 кДж/моль.
Это объясняется тем, что изменение энтальпии таких реакций не зависят от исходных веществ, и определяется при взаимодействии любых сильных кислот и щелочей реакцией:
Н+(р) + ОН‾(р)
= Н2О(ж); ![]() = -57,22 кДж/моль
= -57,22 кДж/моль
Этот факт подтверждает полную диссоциацию сильных электролитов в водных растворах.
Например, нейтрализация азотной кислоты гидроксидом калия
в разбавленных водных растворах сводится к образованию 1 моля жидкой воды, что
следует из ионно-молекулярного уравнения реакции:
НNO3
+ KOH = KNO3 + H2O(ж)
![]()
Н+ + ОН‾ =
Н2О (ж)
2. ЭКСПЕРИМЕНТАЛЬНАЯ
ЧАСТЬ
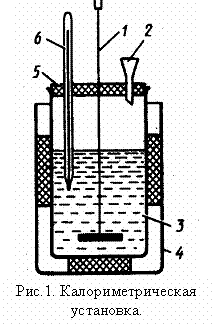 Тепловые
эффекты, сопровождающие химические реакции, измеряют в приборах, называемых
калориметрами или калориметрическими установками (рис.1).
Тепловые
эффекты, сопровождающие химические реакции, измеряют в приборах, называемых
калориметрами или калориметрическими установками (рис.1).
Простейший калориметр состоит из 2-х сосудов: наружного (4) и внутреннего калориметрического (3). Во избежание потерь теплоты через стенки калориметрического сосуда он помещается на подставку из пенопласта (материал с малой теплопроводностью). Калориметр закрывается крышкой (5) с тремя отверстиями: для воронки (2), мешалки (6) и термометра (7).
В работе используют 1 М растворы KOH и HNO3. Для реакции нейтрализации берут равные объемы кислоты и щелочи.
Перед началом опыта необходимо взвесить сухой калориметрический сосуд или узнать его массу у лаборанта.
Соберите калориметрическую установку и через воронку в калориметрический сосуд налейте отмеренные мерным стаканом 50 мл 1 М раствора кислоты. Во второй мерный стакан налейте 50 мл 1 М раствора щелочи и поставьте его на 3-4 мин. для выравнивания температуры рядом с калориметром.
Опустите термометр в стакан
с раствором щелочи и замерьте температуру раствора с точностью до 0,1 К (ТЩ).
Затем, ополоснув шарик термометра водой и осушив его фильтровальной бумагой,
опустите термометр в раствор кислоты. Замерьте температуру раствора кислоты (ТК). Среднее арифметическое ТЩ и ТК даст Т1– начальную температуру раствора в калориметре:
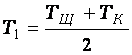 (1)
(1)
Затем через воронку вылейте
раствор кислоты в щелочь. Отметьте самую высокую температуру Т2,
которую покажет термометр после сливания растворов. Результаты измерений
занесите в таблицу 1.
Таблица 1
|
Масса калориметрического
сосуда m, кг |
Суммарный объем жидкости в
стакане V, мл |
Температура, К |
|||
|
ТЩ |
ТК |
Т1 |
Т2 |
||
|
|
|
|
|
|
|
Теплоту, выделяющуюся или
поглощающуюся в калориметре, вычисляют по формуле
q = Σc ·(T2 – T1), (2)
где
Т1 – начальная температура жидкости, К;
Т2 – конечная температура
жидкости в калориметре, К;
Σc – теплоемкость
системы, равная
Σc = с1·m1 + c2·m2 + c3·m3; (3)
c1, c2 – удельная теплоемкость
растворов кислоты, щелочи, принимаемые равными удельной теплоемкости воды, 4,19 кДж/(кг·К);
с3 – удельная теплоемкость стекла 0,75 кДж/(кг·К);
m1, m2 – масса раствора кислоты и
щелочи, кг ‑ (плотность растворов кислоты и щелочи принять равными плотности
воды 1000 кг/м3);
m3 – масса калориметра, кг.
Определить число молей
нейтрализованной кислоты (щелочи) n, учитывая заданную молярную
концентрацию и объем раствора, рассчитать энтальпию нейтрализации.
Так как реакция
нейтрализации является экзотермической, то
ΔН = - q/n, кДж/моль. (4)
Сравнить полученную энтальпию нейтрализации с теоретической и рассчитать относительную ошибку опыта.
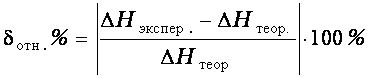 (5)
(5)
Где ![]() экспер. – полученное
в ходе эксперимента значение энтальпии реакции;
экспер. – полученное
в ходе эксперимента значение энтальпии реакции;
![]() теор. – теоретическое
значение энтальпии реакции нейтрализации, равное – 57,22 кДж/моль.
теор. – теоретическое
значение энтальпии реакции нейтрализации, равное – 57,22 кДж/моль.