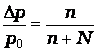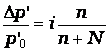7. ДИСПЕРСНЫЕ
СИСТЕМЫ. РАСТВОРЫ
7.1. Дисперсные
системы
Дисперсными называют системы, состоящие из вещества,
раздробленного до частиц большей или меньшей величины и распределенного в
другом веществе. Измельченное (раздробленное) вещество называют дисперсной фазой. Вещество, в котором
распределена дисперсная фаза, называют дисперсионной
средой. Например, в дисперсной системе, которой является туман, дисперсной
фазой являются мельчайшие капельки воды, а дисперсионной средой служит воздух.
Для характеристики дисперсных систем введено понятие степени дисперсности, т.е. степени раздробленности вещества дисперсной фазы – D.
D = 1/a см-1.
Чем больше степень дисперсности, тем меньше размер
частиц. По степени дисперсности все системы можно разделить на грубодисперсные, коллоиднодисперсные, молекулярнодисперсные и ионнодисперсные.
а) Грубодисперсные
системы (размер частиц 10ˉ5 – 10ˉ3
см) – это суспензии, эмульсии, пены.
Суспензии – гетерогенные системы, в которых частицы твердой
дисперсной фазы распределены в жидкой дисперсионной среде. Это, например,
взвесь крахмала в воде, раствор кофе, известковый и цементный раствор.
Эмульсии образуются двумя несмешивающимися жидкостями.
Примерами эмульсий служат молоко, майонез, маргарин, эмульсия бензола в воде.
Пены состоят из ячеек заполненных газом и отделенных
друг от друга жидкими или твердыми пленками. Это мыльная пена, пемза,
пенопласты.
Грубодисперсные системы видны в обычный микроскоп и
даже невооруженным глазом. Могут задерживаться бумажным фильтром. Из-за больших
размеров частиц эти системы неустойчивы и со временем дисперсная фаза отделяется
от дисперсионной среды.
б) Коллоиднодисперсные системы (коллоидные растворы). Размер
частиц дисперсной фазы составляет 10ˉ7 – 10ˉ5 см, а размер частиц дисперсионной среды 10ˉ8 см. Степень дисперсности в коллоидах выше, чем в грубодисперсных
системах. Коллоидные частицы не оседают под действием силы тяжести, проходят
через бумажные фильтры; но они невидимы в обычный микроскоп. Коллоидные
растворы обычно называют золями. В
зависимости от природы дисперсионной среды золи называют гидрозолями – дисперсионная среда – жидкость, аэрозолями – дисперсионная среда воздух.
в) Молекулярнодисперсные и ионнодисперсные
системы (истинные растворы). Размеры
частиц составляют 10ˉ8 см, т.е. равны размерам молекул и ионов. В таких системах гетерогенность
исчезает - системы становятся гомогенными, образуются истинные растворы. К ним
относятся растворы сахара, спирта, неэлектролитов,
электролитов и слабых электролитов. По размерам дисперсных частиц коллоидные
растворы занимают промежуточное положение между грубодисперсными системами и
истинными растворами.
Дисперсные системы также классифицируют по
агрегатным состояниям дисперсной фазы и дисперсионной среды.
Таблица 1
Классификация дисперсных систем по агрегатному состоянию
|
Дисперсионная
среда |
Дисперсная фаза |
Обозначение |
Тип системы |
Пример |
|
Газообразная |
Газообразная |
г/г |
Системы с
флуктуацией плотности |
Атмосфера Земли |
|
Жидкая |
ж/г |
Аэрозоли (туманы) |
Туман, кучевые
облака, тучи, смог |
|
|
Твердая |
т/г |
Аэрозоли (дымы, пыль) |
Табачный дым, угольная
и космическая пыль |
|
|
Жидкая |
Газообразная |
г/ж |
Газовые эмульсии,
пены |
Флотационные,
противопожарные и другие пены, газированные напитки |
|
Жидкая |
ж/ж |
Эмульсии |
Молоко, кремы,
природная нефть |
|
|
Твердая |
т/ж |
Суспензии, пены |
Взвеси в
природных водах, золи металлов, "строительный раствор", пасты,
пульпы |
|
|
Твердая |
Газообразная |
г/т |
Пористые и
капиллярные системы, ксерогели |
Пемза, селикагель, активированные угли, газобетон, пеногипс, пенополимеры |
|
Жидкая |
ж/т |
Пористые и
капиллярные системы, гели |
Адсорбенты,
почвы, влажные грунты, некоторые минералы (опал, жемчуг, бирюза). студни |
|
|
Твердая |
т/т |
Твердые коллоиды |
Сплавы, минералы,
ситаллы, бетон, композиционные материалы |
7.2.
Коллоидные растворы
Коллоидное состояние характерно для многих веществ, если их частицы имеют размер от 10ˉ7 до 10ˉ5 см. Суммарная их поверхность огромна, и она обладает поверхностной энергией, за счет которой может адсорбировать частицы из раствора. Образующаяся коллоидная частица называется мицеллой. Она имеет сложное строение и состоит из ядра, адсорбированных ионов, противоионов.
Если
растворитель взаимодействует с ядром частицы, то образуются лиофильные коллоиды, если не
взаимодействует – то лиофобные
коллоиды.
7.2.1. Строение коллоидных частиц
Коллоидный
раствор можно получить обменной реакцией. Рассмотрим образование иодида серебра при сливании разбавленных растворов
нитрата серебра и иодида калия:
AgNO3 + KI = AgI + KNO3,
![]() .
.
Если
иодид калия и нитрат серебра взяты в эквивалентных количествах, частицы AgI растут, достигая размеров,
превосходящих размеры коллоидных частиц, и быстро выпадают в осадок. Если же
реакцию проводят с разбавленными растворами, то осадок не выпадает, а образуется
коллоидный раствор иодида серебра. Основную массу мицеллы составляет ядро –
мельчайший кристаллик иодида серебра, состоящий из большого числа молекул: m(AgI).
Полученное
ядро является носителем свободной поверхностной энергии, поэтому на его
поверхности идет адсорбционный процесс. Согласно правилу Пескова
– Фаянса, на поверхности ядра мицеллы адсорбируются ионы, имеющиеся в составе
ядра, т.е. адсорбируются ионы, находящиеся в избытке. Если получать раствор при
избытке иодида калия, то адсорбироваться будут ионы иода.
Ионы иода достраивают кристаллическую решетку ядра,
образуя адсорбционный слой, и придают
ядру отрицательный заряд: m[AgI]nI־. Эти
ионы, адсорбирующиеся на поверхности ядра и придающие ему заряд, называются потенциалопределяющими ионами.
В
растворе находятся также ионы противоположные по знаку потенциалопределяющим
ионам, их называют противоионами.
В данном случае это катионы К+, которые электростатически
притягиваются потенциалопределяющими ионами адсорбционного слоя, образуя гранулу:
{m [AgI]nI־ (n – x)K+}x־
г р а н у л а
В
адсорбционном слое гранулы преобладают потенциалопределяющие
ионы I־, число которых можно обозначить n, а
количество противоионов K+– (n-x). Оставшаяся часть противоионов
образует диффузный слой ионов. Ядро с адсорбционным и диффузным слоями
называется мицеллой:
{m [AgI]nI־ (n - x)K+}x־xK+
м и ц е
л л а
Если
получать золь иодида серебра при избытке нитрата серебра, т.е. при избытке Ag+, то коллоидная частица благодаря адсорбции ионов Ag+ на поверхности ядра получит положительный заряд.
{m[AgI]nAg+(n - x)NO3}x+xNO3 (гранула положительна)
{m[AgI]nI־(n - x)K+}x־xK+ (гранула
отрицательна)
Числа
m, n, x в
зависимости от условий приготовления золей могут меняться в широких пределах,
т.е. мицелла не имеет строго определенного состава.
Таким
образом, мицелла – электрически нейтральная коллоидная частица, способная к
самостоятельному существованию. Она определяет все основные свойства коллоидной
системы. Состоит мицелла из ядра кристаллического или аморфного строения,
адсорбционного (неподвижного относительно частицы) и диффузного (подвижного)
слоев. При пропускании постоянного тока через коллоидный раствор к электродам
движутся не мицеллы, которые электронейтральны, а
только гранулы.
Наличие
одноименного заряда у всех частиц золя является фактором его устойчивости.
Заряд препятствует слипанию и укрупнению коллоидных частиц, т.е. коагуляции. Стабильность
(устойчивость) коллоидных частиц объясняется тем, что на поверхности ядер
адсорбируется определенный вид потенциалопределяющих ионов. Те электролиты,
ионы которых являются потенциалопределяющими, следует считать стабилизаторами, а ионы, которые
адсорбируются поверхностью ядер, -
стабилизирующими ионами. При этом на ядре адсорбируются те ионы
стабилизатора, которые содержат элементы, общие с ядром.
7.2.2. Методы получения и очистки коллоидных растворов
Так как коллоидные системы занимают промежуточное положение между грубодисперсными системами и истинными растворами, то их можно получать двумя различными путями: из грубодисперсных систем путем дробления – это методы диспергирования; или из истинных растворов в результате объединения атомов и молекул в агрегаты коллоидной степени дисперсности – методы конденсации.
Методы диспергирования
Механическое измельчение - заключается в энергичном и длительном
растирании, размалывании или распылении дисперсной фазы и смешивании его с
дисперсионной средой. Для устойчивости образующегося золя добавляется
стабилизатор. Дробление осуществляют с помощью коллоидных мельниц, вальцов,
ступок и т.п.
Электрическое диспергирование – состоит в получении золей металлов при контакте двух металлических электродов при пропускании через них тока силой 5 – 10 А и напряжением на электродах 100 В. В области возникшей дуги отрываются частицы от электродов, поступают в среду и образуют золь. Так получают гидрозоли серебра, платины, золота. Их используют в медицине как антисептические лекарственные вещества.
Диспергирование ультразвуком – используют для дробления непрочных веществ с
помощью ультразвуковых колебаний с частотой выше 20000 Гц.
Пептизация
– переход в коллоидный раствор осадков под влиянием дисперсионной среды,
содержащей пептизатор.
Пептизации поддаются только свежие осадки, они легко переходят в золь, а
старые, как правило, не пептизируются. Пептизацию
можно наблюдать при "восстановлении" сухого молока, где пептизатором является белок.
Конденсационные методы
Метод замены растворителя (физическая
конденсация) – основан на замене одного растворителя другим. Если истинный
раствор поваренной соли в этиловом спирте по каплям добавлять в эфир, то
образуется золь поваренной соли в эфире. При этом ионы Na+ и Cl־ образуют
коллоидные частицы из-за плохой растворимости хлорида натрия в эфире.
Метод химической конденсации сводится к образованию молекул нерастворимых
веществ с последующей их конденсацией до размеров коллоидных частиц. При этом
могут использоваться реакции обмена, гидролиза, окисления – восстановления.
После
получения золей коллоидных растворов их необходимо очищать от электролитов,
которые понижают их устойчивость и мешают изучению их свойств.
Очистку
золей проводят методом диализа, а
используемые для этого устройства называют диализаторами.
В них имеется полупроницаемая перегородка, через которую проходят ионы и
молекулы низкомолекулярных веществ, но задерживаются крупные по размеру
коллоидные частицы. Для ускорения этого процесса применяют электрическое поле и
устройства называются электродиализаторами.
Диализ применяют для очистки пищевого желатина, клея, красителей, целлюлозы,
для удаления солей из молочной сыворотки с целью сохранения в ней лактозы и
протеинов. Диализ наблюдается при вымачивании соленого мяса и рыбы.
Метод
отделения дисперсной фазы от дисперсионной среды фильтрованием коллоидных
растворов через полупроницаемые мембраны называется ультрафильтрацией. Для этих целей используют также центрифуги и
ультрацентрифуги. Центрифугирование, например, применяется для сепарирования
молока, отделения мелкокристаллических осадков и т.п.
7.3. Истинные
растворы
Растворы
бывают газообразные (газовые смеси), жидкие и твердые. Газообразным раствором
является воздух. Морская вода – смесь солей в воде – жидкий раствор. Твердые
растворы – металлические сплавы.
Наибольшее
практическое значение имеют жидкие растворы.
Растворы
состоят из растворителя и растворенного вещества (веществ). Основными
параметром состояния раствора является концентрация.
7.3.1. Способы выражения концентрации растворов.
Концентрация раствора – это масса или количество растворенного вещества
в определенном количестве, массе или объеме раствора или растворителя.
Наиболее
распространены следующие способы выражения концентрации растворов.
При постоянной массе раствора
а) Массовая доля (масс.%) – это масса растворенного
вещества, содержащаяся в 100 единицах массы раствора.
б) Молярная доля – Xi – число молей растворенного вещества в 100 молях
раствора.

При постоянной массе растворителя
а) Моляльная
концентрация Сm – количество молей растворенного вещества,
содержащихся в 1 кг растворителя [моль/кг].
При постоянном объеме раствора
а) Молярная концентрация СМ– количество молей
растворенного вещества, содержащаяся в 1 литре раствора [моль/л].
б)
Молярная концентрация эквивалентов
(нормальная концентрация) СН –
количество молей эквивалентов вещества, содержащаяся в 1 литре
раствора [моль/л].
В)
Титр раствора Т – масса растворенного
вещества, содержащаяся в 1 миллилитре раствора [г/мл].
Молярная, массовая доли могут быть выражены в % (умножением на 100); промилле, 0/00 (умножением
на 1000); в частях на миллион, ppm (умножением
на 106); в частях на миллиард, ppb
(умножением на 109).
Пользуясь
растворами, концентрация которых выражена молярной концентрацией эквивалентов,
можно рассчитать объемные отношения реагирующих веществ, так как вещества
реагируют в эквивалентных количествах, то
объемы растворов реагирующих веществ обратно пропорциональны их
молярным концентрациям эквивалентов: V1/V2 = CН2/СН1
7.3.2. Теории образования растворов
В создании современной физико-химической
теории растворов большую роль сыграли работы русских ученых Д.И. Менделеева,
И.А. Каблукова, Д.П. Коновалова и др.
В
конце 19 в. все растворы считались физическими смесями веществ, в которых
отсутствуют взаимодействия между растворенным веществом и растворителем.
Химические явления при растворении были отмечены Д.И. Менделеевым. Взаимодействие
молекул растворителя с растворенным веществом называется сольватацией, а
образующиеся соединения – сольватами. Если растворителем является вода, то
процесс называется гидратацией, а образующиеся соединения – гидратами.
Образованием гидратов можно объяснить выделение теплоты при растворении.
Образованием гидратов можно объяснить скачкообразное изменение свойств
растворов при непрерывном изменении содержания растворенного вещества, что
соответствует изменению состава продукта взаимодействия растворителя с
растворенным веществом при увеличении содержания вещества в растворе.
7.3.3. Явления, наблюдаемые при образовании растворов
Изменение объема
При растворении объем раствора всегда меньше суммы
объемов растворителей и растворяемого вещества.
Так,
при смешении 1 л этилового
спирта с 1 л воды объем образующегося раствора оказывается равным не 2 л, а 1,93
(25°С). Уменьшение
объема обусловлено в основном образованием водородных связей между
гидроксильными группами молекул спирта и воды, а также разрушением льдоподобной структуры воды.
Изменение окраски
Связано
с образованием химических соединений с водой. При выпаривании из растворов
выделяются кристаллы, содержащие воду. Вещества называются кристаллогидратами,
а вода, входящая в их состав – кристаллизационной.
CuSO4 + 4H2O ![]() [Cu(OH2)4]2+SO4
[Cu(OH2)4]2+SO4
Белый голубой р-р.
Кристаллогидрат сульфата меди – CuSO4·5H2O
Изменение энтальпии и энтропии
Растворение
– совокупность физических и химических явлений, при которых происходят
процессы:
а)
разрушение связей в растворяющихся газах, жидкостях или твердых телах -
требуется затраты энергии, ΔН1 > 0.
б)
образование сольватов (или гидратов) сопровождается выделением энергии, ΔН2 < 0.
в)
перемешивание раствора, связанное с диффузией сольватов (гидратов) требует
затраты энергии, ΔН3 > 0.
ΔНр-рения = ΔН1
+ ΔН2
+ ΔН3 .
Так
как тепловой эффект растворения равен алгебраической сумме отдельных процессов
и может быть как положительным так и отрицательным.
Если
растворяются газы или жидкости, то ΔН1 невелико
и ΔН < 0 – экзотермический процесс.
Если
растворяются кристаллические вещества, дробление требует затрат и энергии и ΔН > 0 –
эндотермический процесс.
Растворение
идет самопроизвольно (ΔG < 0) до
насыщения раствора. При этом тепловой
эффект процесса растворения (ΔН) и изменение энтропии при растворении ( ΔS) могут быть и положительными и отрицательными.
Растворение
газов идет с выделением теплоты (ΔН
< 0) и с убылью
энтропии (ΔS < 0). Согласно уравнению
ΔG = ΔН - TΔS, самопроизвольному процессу растворения газа в
воде способствуют низкие температуры.
Растворение
кристаллических веществ часто идет с поглощением теплоты (ΔН
> 0) и обычно
сопровождается ростом энтропии (ΔS > 0). Согласно
уравнению Гиббса, самопроизвольному процессу растворения кристаллических
веществ в воде способствуют высокие температуры. При низких температурах,
возможно, что величина ТΔS
не достигнет значения ΔН и энергия Гиббса
будет положительна (ΔG > 0).
7.3.4. Растворимость
При
растворении вещества может возникать равновесие, при котором скорость
растворения вещества равна скорости
образования.
При
равновесии изменение энергии Гиббса равно нулю, (ΔG = 0).
Раствор, в котором устанавливается равновесие между растворением
и образованием вещества, называется насыщенным, а концентрация такого раствора
– растворимостью.
Так
как растворение газов процесс экзотермический, то их растворимость уменьшается
с увеличением температуры.
Растворимость газов в жидкости пропорциональна их парциальному
давлению над жидкостью (закон Генри).
Поскольку большинство твердых веществ растворяется с поглощением теплоты, то их растворимость возрастает с увеличением температуры. Но растворимость некоторых солей снижается с ростом температуры – FeSO4.H2O, Na2SO4. На растворимость оказывает влияние природа растворителя. Так для органических веществ применимо правило, согласно которому вещество лучше растворяется в таких растворителях, которые химически ему подобны, например, углеводороды в углеводородных растворителях, полярные вещества в полярных растворителях.
7.4. Свойства
растворов неэлектролитов
По
наличию или отсутствию электрической проводимости растворы веществ делят на
электролиты – проводящие электрический ток, и неэлектролиты
– не проводящие электрический ток, в силу отсутствия в них ионов.
Для
описания свойств разбавленных растворов неэлектролитов
используют модель идеального раствора.
Идеальным называют раствор, в котором не происходят химические
реакции между компонентами, а силы межмолекулярного взаимодействия между
компонентами одинаковы.
Образование
этих растворов сопровождается нулевым тепловым эффектом, и каждый компонент в
растворе ведет себя независимо от других компонентов. К идеальным растворам по
свойствам приближаются очень разбавленные растворы неэлектролитов.
К общим свойствам таких растворов относятся понижение давления насыщенного пара
растворителя над раствором и температура замерзания, повышение температуры кипения
и осмотическое давление.
Допустим,
что из раствора при изменении температуры испаряется или кристаллизуется только
растворитель, и, что растворенное вещество является неэлектролитом.
7.4.1. Закон Рауля
Над жидкостью всегда имеется пар в результате естественного процесса испарения. Пар, находящийся в равновесии с жидкостью называется насыщенным. При определенных условиях в системе: Н2О(ж) = Н2О(пар) устанавливается равновесие. Если в эту равновесную систему ввести нелетучее вещество, то концентрация растворителя уменьшится. Это вызовет нарушение равновесия системы. По принципу Ле-Шателье начинает протекать противодействующий процесс, приводящий к конденсации паров воды. Это снижает давления пара. Т.е. давление пара над раствором (р) всегда меньше, чем над чистым растворителем (р0). Разность (р0 – р) = Δр представляет понижение давления пара над раствором. Отношение (р0 – р)/р0 = Δр/р0 - относительное понижение давления пара над раствором.
В
1887 г. французский физик Рауль, изучая
растворы нелетучих жидкостей, установил закон, связывающий понижение давления
пара над разбавленными растворами неэлектролитов с
концентрацией:
относительное понижение давления насыщенного пара растворителя
над раствором равно молярной доле растворенного вещества Δр/р0
= n/(n + N),
где
n – число молей растворенного вещества; N – число
молей растворителя.
Из
закона Рауля возникают два следствия.
Первое следствие из закона Рауля.
Повышение температуры кипения ΔТкип пропорционально моляльности
раствора Сm.
ΔТкип. = КэСm,
где
Кэ
– эбуллиоскопическая постоянная растворителя;
Сm – моляльная концентрация раствора;
ΔТкип. = Ткип р-ра – Ткип.р-рителя.
Повышение
температуры кипения обусловлено тем, что давление насыщенного пара растворителя
над раствором становится равным атмосферному давлению (условие кипения
жидкости) при более высокой температуре, чем в случае чистого растворителя.
Второе следствие из закона Рауля.
Температура замерзания (кристаллизации) раствора ниже температуры
замерзания (кристаллизации) чистого растворителя.
Это
обусловлено более низким давлением пара растворителя над раствором, чем над
чистым растворителем. Понижение температуры
замерзания (кристаллизации) Тзам пропорционально моляльности
раствора
ΔТзам = Кк Сm ,
где
Кк – криоскопическая постоянная,
зависящая от природы растворителя.
Используя
эти уравнения можно определить молярную массу вещества по повышению температуры
кипения раствора (метод эбуллиоскопии)
или по понижению температуры замерзания раствора (метод криоскопии). Для этого экспериментально определяют повышение
температуры кипения или замерзания раствора. Если известна масса растворенного
вещества mB и
растворителя mA, то молярную массу растворенного вещества МВ определяют по уравнению
Мв = 103КmB/(mAΔT).
7.4.2. Осмотическое давление
Если
привести в соприкосновение два раствора с разными концентрациями, то молекулы будут диффундировать преимущественно
в том направлении, где их концентрация ниже. Двусторонняя диффузия приведет к
выравниванию концентраций.
Диффузия
может стать односторонней, если растворы разделить полупроницаемой
перегородкой, пропускающей только молекулы растворителя.
 Такая односторонняя диффузия
растворителя через полупроницаемую перегородку называется осмосом.
Такая односторонняя диффузия
растворителя через полупроницаемую перегородку называется осмосом.
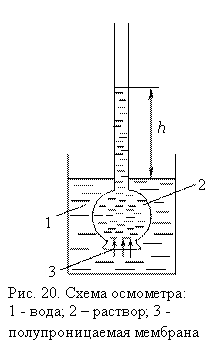
Схема осмометра представлена на рис. 20.
Столб
жидкости с высотой h образовался
за счет осмоса. Осмос прекращается тогда, когда скорости перехода молекул
растворителя в обоих направлениях становятся равными. Количественно осмос
характеризуется осмотическим давлением, равным силе, приходящейся на единицу
площади полупроницаемой перегородки, заставляющей молекулы растворителя
проникать через нее. При равновесии внешнее давление и осмотическое давления
уравновешены. Если внешнее давление, приложенное к более концентрированному
раствору, будет выше осмотического, то скорость перехода молекул растворителя
из концентрированного раствора будет больше, и растворитель будет переходить в
разбавленный раствор. Этот процесс называется обратным осмосом, используется
для очистки природных и сточных вод, для получения питьевой воды из морской. Осмотическое давление возрастает с увеличением
концентрации растворенного вещества и температуры. Вант-Гофф предположил, что для осмотического давления
можно применить уравнение состояния идеального газа
![]() или
или
![]() .
.
Откуда
![]() ,
,
где
π-осмотическое
давление; С –
молярная концентрация раствора.
С = n/V,
n = m/M, С = m/MV.
При
определении осмотического давления можно провести следующую аналогию с
давлением газа.
Известно,
что 1 моль газообразного вещества при 0º С и давлении 101,3
кПа занимает объем 22,4 л. Аналогично,
можно утверждать, что 1 моль вещества, растворенный в 22,4 л
растворителя при 0º С развивает
осмотическое давление 101,3 кПа. Это уравнение позволяет по величине
осмотического давления раствора определять молярную массу (и
относительную молекулярную массу) растворенного вещества.
Пример. Осмотическое
давление раствора, в 250 мл которого содержится 3 грамма
сахара, при 12º С равно 83,14 кПа. Определить относительную молекулярную массу
сахара.
Решение:
Известные данные подставляем в уравнение Вант-Гоффа,
получаем
83,14 . 0,25 = 3.8,314 .
(273 + 12)/Мв,
откуда
Мв = 342 г/моль. А относительная молекулярная масса сахара
равна 342.
7.4.3. Значение осмоса
Осмос
играет важную роль в биологических процессах, обеспечивая поступление воды в
клетки.
Растворы
с одинаковым осмотическим давлением называются изотоническими. Если
осмотическое давление выше внутриклеточного, то оно называется гипертоническим,
если ниже внутриклеточного – гипотоническим.
Гипертонические
растворы сахара (сироп) и соли (рассол) широко применяются для консервирования
продуктов, т.к. вызывают удаление воды из микроорганизмов.
7.5. Свойства
растворов электролитов
В
1887 г. Вант-Гофф установил, что осмотическое давление,
определенное экспериментально для солей, кислот и оснований превышает
вычисленное по уравнению. Подобные отклонения наблюдались в сторону повышения
для температуры кипения и в сторону понижения для температуры замерзания. Так,
молярная масса NaCl, определенная криоскопией, оказалась равной 30, вместо 58,5, а Тзам почти вдвое превышает значение, вычисленное по
закону Рауля. Не зная, чем объяснить эти отклонения, но, стремясь сделать
уравнения пригодными для растворов электролитов, Вант-Гофф ввел в них поправочный множитель: i – изотонический
коэффициент. Законы Рауля и Вант-Гоффа
для растворов электролитов имеют вид:
|
Законы |
Неэлектролиты |
Электролиты |
|
Законы
Рауля |
|
|
|
|
|
|
|
|
|
|
|
Закон
Вант-Гоффа |
|
|
Здесь
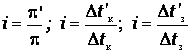
Найденные Вант-Гоффом значения i для растворов солей, кислот, оснований имеют разные значения, зависящие от природы и концентрации растворителя, и изменяются от 1 до 4.
Увеличение
π', Δt'к, Δt'з
в растворах электролитов вызвано
увеличением числа частиц в растворах, т.е. диссоциацией электролитов на ионы.
В
1887 году С. Аррениус положил это
предположение в основу своей теории, объясняющей поведение солей, кислот, оснований в водных
растворах.
Активность. Законы Рауля и Вант-Гоффа соблюдаются лишь в разбавленных растворах неэлектролитов. По мере повышения концентрации
растворенного вещества возрастают отклонения от законов идеальных растворов.
Эти отклонения обусловлены различного рода взаимодействиями между частицами
растворенного вещества, растворенного вещества и растворителя. Поэтому для
учета этих взаимодействий в законы идеальных растворов было предложено ввести
вместо концентраций компонентов активности. Активность
а связана с
концентрацией соотношением
![]() ,
,
где
![]() - коэффициент
активности, формально учитывает взаимодействия частиц в растворе, приводящие к
отклонению от свойств идеального раствора.
- коэффициент
активности, формально учитывает взаимодействия частиц в растворе, приводящие к
отклонению от свойств идеального раствора.
Коэффициент активности вычисляют по экспериментальным данным. Для этого измеряют какое-либо свойство раствора и определяют коэффициент активности как частное от деления экспериментально полученной величины на теоретически рассчитанную по законам идеальных растворов:
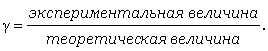
Итак,
общие свойства растворов выражаются законами Рауля и Вант-Гоффа. В реальных растворах вместо концентрации
используется активность.
7.6. Теория
электролитической диссоциации
В
растворе электролита имеет место электролитическая диссоциация с образованием
ионов. Эта идея была выдвинута С.Аррениусом.
Диссоциация – самопроизвольный распад электролита
на ионы.
Положительно
заряженные ионы называются катионами, отрицательно заряженные – анионами.
Распад электролитов на ионы объясняет отклонения от законов Рауля и Вант-Гоффа. Так, хлорид натрия переходит в раствор в виде ионов Na+ и Cl‾. При этом из одного моля NaCl получается не 6,02 .1023 частиц, а вдвое больше. Поэтому и понижение температуры замерзания в растворе NaCl должно быть вдвое больше, чем в растворе неэлектролита той же концентрации.
Точно так же в очень разбавленном растворе BaCl2, диссоциирующего по уравнению
BaCl2 = Ba2+ + 2Cl‾,
осмотическое
давление оказывается в 3 раза больше чем, если бы хлорид бария находится в
нем в виде молекул BaCl2.
Таким
образом, особенности водных растворов электролитов, противоречащие с первого
взгляда законам Рауля и Вант-Гоффа,
были объяснены на основе этих же законов.
Однако
теория Аррениуса не учитывала всей сложности явлений в растворах. Она
рассматривала ионы как независимые от растворителя частицы. Но ей противостояла
гидратная теория Менделеева, в основе которой лежало
представление о взаимодействии растворенного вещества с растворителем.
Кажущееся противоречие обеих теорий было устранено предположением о гидратации ионов (И.А. Каблуков). Развитие этой идеи привело к
объединению теорий Аррениуса и Менделеева.
Распадаться на ионы могут только те молекулы, в которых химическая связь имеет достаточно высокую степень ионности. Чтобы ионы молекулы электролита меньше притягивались друг к другу, растворитель должен обладать высоким значением относительной диэлектрической проницаемости (ε). Распаду электролита способствуют растворители с высоким значением ε. К ним относится вода (ε = 80,1), уксусная кислота (ε = 57), этиловый спирт (ε = 25).
Вещества
могут распадаться на ионы и при расплавлении, когда энергии теплового движения
оказывается достаточно для разрыва полярных связей.
Таким
образом,
электролитическая диссоциация – это процесс распада молекул
веществ на ионы под действием полярных молекул растворителя, а также при их
расплавлении.
В
зависимости от структуры растворяющегося вещества в безводном состоянии его
диссоциация протекает по-разному. Наиболее типичны два случая. В одном - диссоциация
протекает при растворении веществ с ионной структурой, в другом - при
растворении веществ с полярной связью.
Когда
кристалл соли с ионной связью попадает в воду, то расположенные на его
поверхности ионы притягивают к себе полярные молекулы воды (это ион дипольное
взаимодействие). Ионы вещества и молекулы воды притягиваются друг к другу
противоположными полюсами. Ионы испытывают тепловые колебания и толчки со
стороны молекул воды и этого достаточно, чтобы ионы перешли из кристалла в
раствор. Вслед за первым слоем ионов в раствор переходит следующий слой и таким
образом происходит растворение кристаллических веществ с ионной связью.
Полярные молекулы растворяющихся веществ притягивают к себе полярные молекулы воды за счет диполь – дипольного взаимодействия, вызывая расхождение полюсов молекулы вещества. Происходит поляризация молекулы, которая совместно с колебательным движением атомов и тепловым движением молекул воды приводит к распаду полярной молекулы на ионы. Образующиеся в обоих случаях ионы гидратируются. При этом ион водорода Н+ (протон) прочно связывается с молекулой воды в ион гидроксония Н3О+. Схематически это можно представить уравнением:
Н2О + НCl = Н3О+ + Cl‾.
В результате этого процесса общая пара электронов молекулы НCl остается у атома хлора, который превращается в ион Cl‾, а протон, внедряясь в электронную оболочку кислорода молекулы воды, образует ион гидроксония Н3О+.
Протон водорода благодаря малым размерам и электростатическому полю высокой напряженности, а также отсутствию у него электронной оболочки, в водных растворах существует только в виде комплексов с молекулами воды Н3О+ окруженных другими молекулами воды.
Перешедшие
в раствор ионы остаются связанными с молекулами воды и образуют гидраты ионов. В случае другого
растворителя эти соединения называются сольватами
ионов. Но в уравнениях диссоциации обычно пишут формулы ионов, а не их гидратов
или сольватов.
7.7. Степень диссоциации. Сила электролита
В
растворах некоторых электролитов диссоциирует лишь
часть молекул. Для количественной оценки процесса диссоциации было введено
понятие степени электролитической диссоциации. Отношение числа молекул, диссоциированных на ионы, к общему числу молекул
растворенного электролита называется степенью диссоциации ![]() . По степени диссоциации в растворах все электролиты делятся
на две группы. К первой относят электролиты, степень диссоциации которых в растворах равна единице и почти не зависит от
концентрации раствора. Их называют сильными
электролитами. К сильным электролитам в водных растворах принадлежит
подавляющее большинство солей, щелочей, а также некоторые кислоты. В водных
растворах они диссоциируют практически полностью. Истинная степень их
диссоциации близка к 1 (100%), хотя экспериментально наблюдаемая (кажущаяся)
находится в пределах от 30 % и выше.
. По степени диссоциации в растворах все электролиты делятся
на две группы. К первой относят электролиты, степень диссоциации которых в растворах равна единице и почти не зависит от
концентрации раствора. Их называют сильными
электролитами. К сильным электролитам в водных растворах принадлежит
подавляющее большинство солей, щелочей, а также некоторые кислоты. В водных
растворах они диссоциируют практически полностью. Истинная степень их
диссоциации близка к 1 (100%), хотя экспериментально наблюдаемая (кажущаяся)
находится в пределах от 30 % и выше.
Электролиты,
степень диссоциации которых в растворе меньше единицы и уменьшается с ростом
концентрации, называют слабыми
электролитами. Слабые электролиты диссоциируют на ионы в очень малой
степени, в растворах они находятся, в основном, в недиссоциированном состоянии;
для них α
< 3%. К ним относят воду, ряд кислот, основания р-,
d- и f- элементов. Между этими группами нет четкой
границы, одно и тоже вещество в одном растворителе является сильным, а в другом
– слабым электролитом.
Согласно
теории электролитической диссоциации,
кислотой является электролит, который диссоциирует с
образованием ионов Н+. Присутствием ионов Н+ можно обьяснить кислый
вкус, способность изменять цвет индикаторов, взаимодействовать с основаниями а также с некоторыми металлами с выделением
водорода.
Сильные
кислоты (HCl, HNO3,
H2SO4
и др.) диссоциируют практически полностью, у
слабых кислот диссоциирована лишь часть молекул. О
силе кислот можно судить и по константе диссоциации: чем она больше, тем более диссоциирована кислота.
Электролит, диссоциирующий
с образованием ионов ОН‾, называется основанием. Наличием ионов ОН‾
в растворе объясняется своеобразный
"мыльный " вкус, способность изменять цвета индикаторов иначе, чем
кислотами, способность взаимодействовать с кислотами с образованием солей.
Сильные основания (LiOH, NaOH, KOH и др.) диссоциируют полностью, у слабых оснований диссоциирована лишь часть молекул.
Существуют
электролиты, которые могут диссоциировать как
кислоты, и как основания:
H+ + RO‾ = ROH = R+ + OH‾
Такие
электролиты называются амфотерными электролитами. Амфотерность
электролитов объясняется малым различием прочности связей R - H и О - Н. Примером
амфотерного электролита может быть гидроксид цинка:
2Н+ + [Zn(OH)4]2‾ = Zn(OH)2 + 2H2O = [Zn(H2O)2]2+ + 2OH‾.
При
взаимодействии гидроксида цинка с азотной кислотой
образуется нитрат цинка:
Zn(OH)2 +
2HNO3 = Zn(NO3)2 + 2H2O
при
взаимодействии же с гидроксидом калия – гидроксоцинкат калия:
Zn(OH)2 + 2KOH =
К
амфотерным электролитам относятся гидроксиды
алюминия Al(OH)3, свинца
Pb(OH)2, олова Sn(OH)2.
Соли
можно определить как электролиты, которые при растворении в воде диссоциируют с
образованием положительных ионов отличных от ионов водорода и отрицательных
ионов, отличных от гидроксид-ионов. Соли тем лучше
диссоциируют, чем меньше заряды ионов, образующих соль.
7.7.1. Константа диссоциации
В
растворах слабых электролитов процесс диссоциации протекает обратимо и,
следовательно к нему можно применить закон действующих масс и записать
константу равновесия слабого электролита, она называется константа диссоциации:
АВ = А+ + В‾
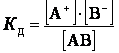
HCN = H+ + CN‾
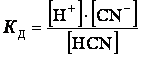 .
.
КД зависит
от природы электролита и растворителя, от температуры и не зависит от
концентрации раствора. Чем выше КД, тем
легче электролит диссоциирует.
Многоосновные
кислоты диссоциируют ступенчато:
![]()
![]() 1-я ступень
диссоциации
1-я ступень
диссоциации
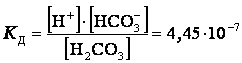
![]() 2-я ступень диссоциации
2-я ступень диссоциации
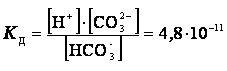
Суммарному равновесию ![]() отвечает суммарная
константа диссоциации КД
отвечает суммарная
константа диссоциации КД
![]()
Аналогично для основания Fe(OH)2.
При ступенчатой диссоциации веществ распад по последующей ступени всегда происходит в меньшей степени, чем по предыдущей. Соблюдается неравенство: КД1 > КД2 > КД3…. Это объясняется тем, что энергия необходимая для отрыва иона от нейтральной молекулы меньше, чем при диссоциации по каждой следующей ступени.
7.7.2. Закон разбавления Оствальда
Пусть для слабого электролита ![]()
С – концентрация электролита; α - степень диссоциации; С.α - концентрация каждого из ионов; С.(1 - α) – концентрация недиссоциированных молекул.
Тогда выражение КД
запишется:
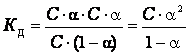 ,
,
Полученное выражение называется законом Оствальда.
Для разбавленных растворов, если α << 1, то ![]() , откуда
, откуда
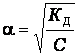 .
.
Полученное выражение показывает, что
степень диссоциации возрастает при
разбавлении,
и выражает закон разбавления Оствальда.
Итак, поведение слабых электролитов описывается законом Оствальда, а сильных – моделью ионной атмосферы. Но общей теории не создано.
7.7.3. Произведение растворимости
Применим закон действующих масс к равновесной
системе, состоящей из кристаллов малорастворимого вещества и его ионов в
насыщенном растворе:
![]()
При равновесии в единицу времени в раствор
переходит столько ионов, сколько их снова возвращается в осадок. Это равновесие
характеризуется величиной Кравн, которую называют произведением растворимости ПР, то есть
в насыщенном растворе малорастворимого
электролита произведение концентраций его ионов в степени стехиометрических
коэффициентов при данной температуре есть величина постоянная.
![]()
ПР характеризует растворимость вещества: чем больше
ПР, тем больше растворимость.
Из понятия ПР вытекает условие образования и
растворимости осадков.
Если ![]() - система находится в равновесии.
- система находится в равновесии.
Если ![]() - наблюдается
выпадение осадка.
- наблюдается
выпадение осадка.
Если ![]() - происходит
растворение осадка.
- происходит
растворение осадка.
7.8. Электролитическая диссоциация воды. Водородный
показатель
7.8.1. Ионное произведение воды
Изучение очищенной от примесей воды показало, что
она обладает электропроводностью, повышающейся с ростом температуры. Это можно
объяснить небольшой самодиссоциацией воды на ионы
водорода и гидроксид-ионы (автопротолизом):
![]()
По величине электрической проводимости чистой воды можно вычислить концентрацию ионов гидроксония Н3О+ и гидроксид-ионов в воде. При 25º С она равна 10‾7 моль/л.
Константа диссоциации воды может быть вычислена по
уравнению
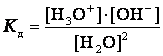 ,
,
Перепишем
это уравнение следующим образом:
![]()
Поскольку степень диссоциации воды очень мала, то концентрация недиссоциированных молекул Н2О в воде равна общей концентрации воды, т.е. 55,55 моль/л (1 л содержит 1000 г воды, т.е. 1000/18 = 55,55 моль). В разбавленных растворах концентрацию воды можно считать такой же.
Поэтому, заменив произведение Кд 55,55 = Кв новой константой Кв, будем иметь:
[H3O+][OH‾] = Kв.
Полученное уравнение показывает, что
для воды и разбавленных водных
растворов при неизменной температуре произведение концентраций ионов гидроксония и гидроксид-ионов
есть величина постоянная. Она называется ионным
произведением воды.
Численное ее значение можно получить, если подставить концентрации ионов гидроксония и гидроксид-ионов. В чистой воде при 25ºС [H3O+] = [OH‾] = 1·10‾7 моль/л. Поэтому для указанной температуры:
Кв = 10‾7.10‾7
=10‾14.
Диссоциацию воды часто записывают в более простом
виде:
Н2О = Н+ + ОН‾.
Кв
– не зависит от концентрации ионов Н+ и ОНˉ.
Так, если в воду добавить кислоты,
концентрация ионов Н+ резко возрастет. Тогда за счет подавления диссоциации воды равновесие этого процесса
сместится влево и концентрация ионов ОНˉ
уменьшится, но ионное произведение воды
останется неизменным.
7.8.2. Водородный показатель рН
В соответствии теорией электролитической диссоциации ионы Н+ являются носителями кислотных свойств, а ионы ОНˉ - носителями основных свойств. Поэтому раствор будет нейтральным, когда
![]() ;
;
кислым, когда
![]() ;
;
и щелочным, когда
![]()
Для
характеристики кислотности (щелочности) среды введен специальный параметр –
водородный показатель, или pH.
Водородным показателем, или pH, называется
взятый с обратным знаком десятичный логарифм концентрации водородных ионов в
растворе:
![]()
Из ионного произведения следует:
![]()
![]()
![]()
рН + рОН = 14.
Таким образом, зная рОН , можно легко рассчитать рН, и наоборот, по известному значению рН легко определяется рОН.
Величина рН может служить критерием силы кислоты или основания. В ряду кислот наиболее сильной будет та, у которой при одинаковой молярной концентрации, концентрация ионов Н+ выше (рН ниже).
Водородный
показатель имеет важное значение для жизнедеятельности организма, так в норме
рН сыворотки крови равен 7,40, слюны
– 6,35 - 6,85, желудочного сока 0,9 – 1,1.
Отклонение рН от нормальных значений приводит к расстройству
деятельности организма.
7.8.3. Кислотно-основные индикаторы
Кислотно-основные
индикаторы – это вещества, меняющие свою окраску в определенной
области значений pH
раствора.
Индикаторами
могут быть слабые органические кислоты HInd и
основания IndOH,
молекулы и ионы которых имеют разную окраску. В исследуемых растворах
индикаторы диссоциируют:
![]()
![]()
Так
как процесс диссоциации слабых электролитов обратим, равновесие в этих системах
зависит от кислотности раствора. В кислых растворах индикаторы, представляющие
собой слабые кислоты, находятся в виде молекул и окраска соответствует
молекулярной форме индикатора HInd. Индикаторы, являющиеся слабыми основаниями, в растворах кислот будут
находится в своей ионной форме Ind+,
которая обусловливает окраску раствора.
рН определяют с помощью индикаторов или приборов рН- метров.
7.8.4. Буферные растворы
Растворы, рН
которых относительно мало изменяется при добавлении небольших количеств кислоты
или основания, называются буферными.
Они
обычно содержат слабую кислоту и ее соль, например СН3СООН + СН3СООNa или слабое
основание и его соль, например, NH4OH + NH4Cl. В растворе кислота и соль диссоциируют:
СН3СООН = СН3СООˉ + Н+
CH3COONa = CH3COOˉ + Na+
При
добавлении кислоты в раствор ионы
водорода связываются в слабую кислоту
Н+ + СН3СООˉ = СН3СООН
При добавлении основания в раствор ОНˉ ионы
связываются в слабый электролит Н2О
Н+ + ОНˉ = Н2О.
Образование
слабых электролитов при добавлении в буферные растворы кислоты или основания и
обусловливает устойчивость рН.
7.8.5. Гидролиз солей
Гидролиз – это разложение веществ водой. Гидролизу
подвергаются углеводы, белки, жиры; в промышленности ведут гидролиз древесины.
В неорганической химии чаще приходится иметь дело с гидролизом солей.
Гидролиз солей – это обменное
взаимодействие ионов соли с молекулами воды, приводящее к образованию слабого
электролита и смещению равновесия электролитической диссоциации воды.
В
результате гидролиза в растворе появляется избыток ОНˉ или Н+,
среда становится основной или кислой.
Гидролиз
является результатом поляризационного взаимодействия ионов солей с их гидратной оболочкой. Чем значительнее это взаимодействие,
тем интенсивнее протекает гидролиз. Сущность гидролиза можно представить
следующим образом.
Катионы соли связываются в растворе с гидратирующими их молекулами воды донорно–акцепторной
связью. Донор – атомы кислорода воды, акцепторы – катионы, имеющие свободные
атомные орбитали.
Анионы
соли связываются с молекулами воды водородной
связью. Сильное воздействие анионов соли на воду может привести к отрыву
протона и тогда образуется анион вида ![]() .
.
В
зависимости от силы поляризационного влияния катиона и аниона соли на молекулы
воды образуются различные продукты гидролиза.
Различают
4 варианта действия воды на соли:
1)
Если катионы и анионы незначительно воздействуют на ![]() , то взаимодействие соли с
, то взаимодействие соли с ![]() практически не
происходит. Это относится к солям,
образованным сильными основаниями и сильными кислотами, они гидролизу не
подвергаются:
практически не
происходит. Это относится к солям,
образованным сильными основаниями и сильными кислотами, они гидролизу не
подвергаются: ![]() .
.
Равновесие
диссоциации воды при этом не нарушаются и pH = 7.
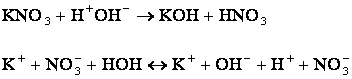
2) Если соль образована катионом сильного
основания и анионом слабой кислоты (![]() ), то происходит гидролиз
по аниону.
), то происходит гидролиз
по аниону.
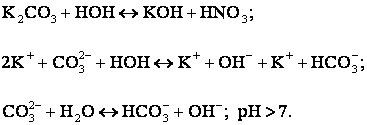
Чем
больше поляризующее влияние анионов, (т.е. чем слабее кислота) тем интенсивнее
гидролиз.
3) Если соль образована катионом слабого основания и анионом сильной
кислоты, то происходит гидролиз по
катиону.
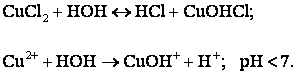
Здесь
гидролиз обусловлен образованием малодиссоциирующих
частиц ![]() . Равновесие электролитической диссоциации
. Равновесие электролитической диссоциации ![]() смещается вправо и
в растворе появляется избыток ионов
смещается вправо и
в растворе появляется избыток ионов ![]() , pH < 7, среда
кислая, т.е. чем слабее основание, тем полнее будет гидролиз.
, pH < 7, среда
кислая, т.е. чем слабее основание, тем полнее будет гидролиз.
4)
Если соль образована катионом слабого основания и анионом слабой кислоты, то
идет гидролиз по катиону и по аниону.
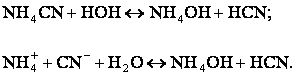
В
зависимости от соотношения констант диссоциации образующихся при гидролизе
кислоты и основания, растворы солей этого типа могут иметь слабокислую или
слабощелочную реакцию, т.е. ![]() .
.
5)
Гидролиз некоторых солей, образованных очень слабыми основаниями и кислотами,
является необратимым. Это карбонаты и сульфиды хрома, алюминия и железа. Эти
соединения нельзя получить в водном растворе, они гидролизуются с образованием гидроксидов и выделением газа:
![]() .
.
7.8.6. Параметры гидролиза
Гидролизу
подвергается не все количество находящейся в растворе соли, а только часть его.
То есть в растворе устанавливается равновесие между солью и образующими ее
кислотой и основанием. Доля вещества, подвергающаяся гидролизу - степень гидролиза β–
зависит от константы этого равновесия, а также от температуры и концентрации
соли. Степень гидролиза представляет собой отношение концентрации гидролизованных молекул сгидр к исходной концентрации растворенных молекул соли с:
β = сгидр/с
Степень гидролиза, как правило, невелика, т.к. вода
является слабым электролитом и положение равновесия реакции гидролиза сильно смещено
в сторону исходных веществ. Степень гидролиза возрастает с увеличением
температуры, поскольку гидролиз – процесс
эндотермический.
Запишем
константу равновесия для реакции гидролиза аниона слабой кислоты:
![]()
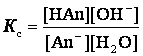
Так
как концентрация воды при гидролизе изменяется очень мало, то, принимая ее
постоянной и умножая на константу равновесия, получим константу гидролиза Кг:
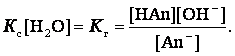
Умножая числитель и знаменатель на равновесную концентрацию
ионов водорода, получаем
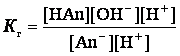
Произведение [OH‾][H+] = Kв, а отношение ![]()
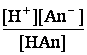
является константой диссоциации Кк слабой кислоты НAn.Таким образом, константа гидролиза равна отношению
ионного произведения воды и константы диссоциации слабого электролита:
Кг = Кв/Кк
Это
уравнение показывает, что Кг тем больше, чем меньше константа диссоциации
кислоты. Иными словами, чем слабее
кислота, тем в большей степени подвергается гидролизу ее соль.
Пусть
с - исходная концентрация аниона ![]() ,
,
![]() - количество ионов,
подвергшихся гидролизу.
- количество ионов,
подвергшихся гидролизу.
![]() - количество негидролизованных
ионов.
- количество негидролизованных
ионов.
Подставим
это выражение в уравнение ![]()
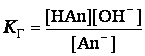
получим,
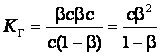 .
.
Если степень гидролиза мала (β <<1), то ![]()
Отсюда следует, что
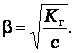
Как
видно,
степень гидролиза возрастает с уменьшением концентрации гидролизующегося иона.
Если
гидролизу подвергается многоосновной анион, то гидролиз протекает по стадиям:
![]()
![]()
Константа гидролиза по первой ступени значительно
выше, чем константа гидролиза по последней ступени. Поэтому второй и третьей ступенью
гидролиза обычно пренебрегают.
Для
солей, образованных сильной кислотой и слабым основанием, константа гидролиза
имеет выражение:
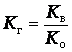
Поэтому,
чем слабее основание, тем в большей степени
подвергаются гидролизу образованные им соли.
Для
солей, образованных слабой кислотой и слабым основанием, константа гидролиза
связана с константами диссоциации кислоты и основания следующим соотношением:
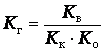 ,
,
то есть,
чем слабее кислота и основание, тем в
большей степени соль подвергается гидролизу.