6.1.
Скорость химических реакций
Раздел химии, изучающий скорости и
механизмы химических реакций, называется химической кинетикой.
Химические реакции протекают с различными скоростями. Некоторые из них заканчиваются за секунды, другие - за минуты, часы, дни; некоторые для своего протекания требуют десятилетий. Кроме того, одна и та же реакция может протекать быстро при повышенных температурах и медленно – при охлаждении.
Знание скоростей химических реакций имеет большое значение, так как определяет размеры и производительность аппаратуры, количество получаемого продукта. На практике важно знать, как изменить условия, чтобы реакция протекала с требуемой скоростью.
Скорость химической реакции – это изменение количества реагирующего вещества или
продукта реакции за единицу времени в единице объема (для гомогенной реакции)
или на единице поверхности раздела фаз (для гетерогенной реакции).
Гомогенной называется реакция, протекающая в однородной среде (в одной фазе). Гетерогенные реакции протекают на границе раздела фаз, например твердой и жидкой, твердой и газообразной. Отношение количества вещества к единице объема называется концентрацией с, моль/л.
Различают среднюю и мгновенную скорости реакции. Средняя скорость реакции равна:
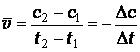 ,
,
где с2и с1 – концентрации исходного вещества в момент времени t2 и t1.
Знак минус означает, что концентрация исходного вещества уменьшается. В ходе реакции изменяются концентрации реагирующих веществ и соответственно скорость реакции. Скорость реакции в данный момент времени или, мгновенная (истинная) скорость реакции, равна:
![]()
Скорость реакции принимается всегда положительной, поэтому производная исходных концентраций берется со знаком минус, а продуктов реакции – со знаком плюс.
Скорость реакции имеет единицу измерения [моль м-3 с-1], [моль л-1с-1].
Скорость реакции зависит от природы реагирующих веществ. Некоторые реакции протекают со взрывом, другие могут идти годами. На скорость реакции влияют такие факторы как концентрация веществ, температура, катализаторы.
6.1.1 Зависимость скорости реакции от концентрации веществ
Чтобы произошла реакция, необходимо столкновение реагирующих частиц. Число столкновений растет с увеличением числа реагирующих частиц в единице объема, т.е. с увеличением концентрации веществ. Это утверждение нашло отражение в законе действующих масс, который установили в 1867 г. норвежские химики К.Гульдберг и П. Вааге:
при
постоянной температуре скорость химической реакции прямо пропорциональна
произведению концентраций реагирующих веществ, взятых в степенях, равных
стехиометрическим коэффициентам в уравнении реакции.
Для реакции
bB + dD = lL + mM
выражение кинетического уравнения скорости имеет вид
![]() ,
,
где k – константа скорости реакции, не зависит от концентрации веществ, но зависит от их природы и температуры; b и d –порядки реакции, установленные опытным путем (для простых реакций совпадают со стехиометрическими коэффициентами в уравнении), сА и сВ – концентрации реагентов.
Закон действующих масс справедлив лишь для наиболее простых по своему механизму реакций, протекающих в газах или растворах. Часто уравнение реакции не отражает ее механизма. Сложные реакции можно представить как совокупность простых процессов, протекающих последовательно или параллельно. Закон действующих масс справедлив для каждой отдельной стадии реакции, но не для всего взаимодействия в целом. Та стадия процесса, скорость которой минимальна, лимитирует (определяет) скорость реакции, в общем. Поэтому закон действующих масс для лимитирующей стадии процесса приложим и ко всей реакции в целом.
6.1.2. Особенности кинетики гетерогенных реакций
Гетерогенные реакции имеют большое значение в технике: это горение твердого и жидкого топлива, коррозия металлов и сплавов. В этом случае реакция идет на поверхности раздела фаз, которая служит реакционным пространством гетерогенной химической реакции. Концентрацию газообразных и жидких веществ в реакции измеряют количеством молей приходящихся на единицу реакционной поверхности (моль/м2, моль/см2) и называют поверхностной концентрацией – сs.
![]() ,
,
![]() .
.
Зависимость скорости гетерогенной химической реакции от поверхностной концентрации веществ в реакции определяется законом действующих масс. Так, реакция горения угля протекает тем быстрее, чем интенсивнее подается к углю кислород. В случае гетерогенных реакций в уравнение закона действующих масс входят концентрации только тех веществ, которые находятся в газовой фазе или в растворе. Концентрация вещества, находящегося в твердой фазе, обычно представляет собой постоянную величину и поэтому входит в константу скорости. Например, для гетерогенной реакции горения угля
С(к) + О2(г)
= СО2(г)
кинетическое выражение уравнения скорости реакции по закону действующих масс запишется так
![]() ,
,
где ![]() ;
;
k – константа скорости реакции;
сs (О2) –поверхностная концентрация кислорода, моль/м2 .
В некоторых случаях из-за трудностей измерения поверхностной концентрации используют объемную концентрацию (моль/л). Например, скорость реакции Si(к) + О2(г) = SiО2(к) рассчитывают по уравнению
![]() ,
,
где v – скорость реакции, моль/(л с);
k – константа скорости, 1/с;
с(О2) – концентрация О2 в газообразной фазе над реакционной поверхностью, моль/л.
Измерение скорости гетерогенных реакций в моль/(л с) приводит к тому, что скорость становится функцией площади реакционной поверхности, так как чем больше эта площадь, тем больше число столкновений молекул реагирующих веществ, находящихся в разных фазах гетерогенной системы. Число столкновений на единице поверхности раздела фаз постоянно и применительно к гетерогенным процессам по закону действующих масс скорость не зависит от площади поверхности раздела фаз, так же как скорость гомогенной реакции не зависит от объема системы.
6.1.3. Зависимость
скорости реакции от температуры
Правило Вант – Гоффа. Повышение температуры ускоряет большинство химических реакций. Согласно эмпирическому правилу Вант- Гоффа при повышении температуры на 10 К скорость многих реакций увеличивается в 2 – 4 раза
![]()
где v2 и v1 - скорости реакции при температурах Т2 и Т1, γ - коэффициент, значение которого для эндотермической реакции выше, чем для экзотермической. Для многих реакций γ лежит в пределах 2 – 4.
При концентрациях реагирующих веществ 1 моль/л скорость реакции численно равна константе скорости k. Правило Вант – Гоффа запишется так:
![]()
Уравнение показывает, что константа скорости зависит от температуры так же, как и скорость процесса.
Эти два уравнения можно использовать лишь для ориентировочных расчетов, так как точность их не очень высока.
В 1889 г. шведский ученый Сванте Аррениус на основании экспериментов вывел уравнение, которое названо его именем
![]() ,
,
где k – константа скорости реакции; А – предэкспоненциальный множитель; е – основание натурального логарифма; Еа – постоянная, называемая энергией активации, определяемая природой реакции. Значения Еа для химических реакций лежат в пределах 40 – 400 кДж/ моль.
После логарифмирования уравнение имеет вид
![]()
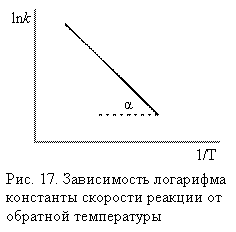 Если
представить графическую зависимость lnk = f(1/T),
то она имеет вид (рис 17).
Если
представить графическую зависимость lnk = f(1/T),
то она имеет вид (рис 17).
Здесь tgα = -Еа/R и Еа = - Rtgα. Отрезок, отсекаемый на оси ординат равен lnА.
Итак, константа скорости реакции (и скорость) возрастает с увеличением температуры по экспоненциальному закону. В соответствии с уравнением Аррениуса константа скорости реакции уменьшается с ростом энергии активации. Уравнение Аррениуса позволяет рассчитывать константы скорости (и скорости) при различных температурах.
Аррениус предположил, что реагировать между собой могут только те молекулы, которые находятся в активной форме, образующиеся из обычных молекул. Такие молекулы были названы активными, а энергия, необходимая для перевода обычных молекул в активное состояние, энергией активации.
В самом деле, в ходе химической реакции разрушаются одни и возникают другие молекулы, происходит изменение химических связей, т.е. перераспределение электронной плотности. Если бы старые связи в ходе реакции сразу полностью разрушались, то на это потребовалось бы большое количество энергии, и реакция протекала крайне медленно. Как показали исследования, в ходе реакции система проходит через переходное состояние, через образование активированного комплекса. Например, ход реакции
АВ + DC = AD + BC
можно представить схемой
|
A – B + D ‑ C |
→ |
A . . . B : : : : D . . . C |
→ |
A B │ │ D C |
|
Исходные молекулы |
|
Активированный комплекс |
|
Продукты реакции |
В активированном комплексе старые связи еще не разорваны, но уже ослаблены, новые связи наметились, но еще не образовались. Время существования его не велико (10‾14 – 10‾11 с). При распаде комплекса образуются либо продукты реакции, либо исходные вещества. Для образования переходного комплекса необходима энергия. Система в переходном состоянии имеет более высокую энергию, чем в исходном и конечном состояниях.
Энергия, необходимая для перехода вещества в состояние активированного комплекса, называется энергией активации.
Образование активированного комплекса определяется энергией
молекул. Молекула, энергия ко![]()
 торой
достаточна для образования активированного комплекса, называется активной. Доля
таких молекул зависит от температуры. При высоких температурах доля активных
молекул, энергия которых равна или выше энергии активации, велика и,
соответственно, растет доля молекул способных к активным столкновениям с
образованием активированного комплекса, т.е. реакции идут быстро. Чем выше
энергия активации, тем меньше доля частиц, способных к активному
взаимодействию. Экзотермические реакции протекают с меньшей энергией активации,
чем эндотермические (рис.18). Высокая энергия активации (высокий энергетический
барьер) является причиной того, что многие химические реакции при невысоких
температурах не протекают, хотя термодинамически
возможны (ΔG < 0).
торой
достаточна для образования активированного комплекса, называется активной. Доля
таких молекул зависит от температуры. При высоких температурах доля активных
молекул, энергия которых равна или выше энергии активации, велика и,
соответственно, растет доля молекул способных к активным столкновениям с
образованием активированного комплекса, т.е. реакции идут быстро. Чем выше
энергия активации, тем меньше доля частиц, способных к активному
взаимодействию. Экзотермические реакции протекают с меньшей энергией активации,
чем эндотермические (рис.18). Высокая энергия активации (высокий энергетический
барьер) является причиной того, что многие химические реакции при невысоких
температурах не протекают, хотя термодинамически
возможны (ΔG < 0).
Итак, энергия активации – это энергия, необходимая для перехода частиц в состояние активированного комплекса. Частицы, энергия которых равна или выше энергии активации, называются активными. С ростом температуры растет доля этих частиц и соответственно скорость реакции. С увеличением энергии активации уменьшается доля активных молекул и скорость реакции.
6.1.6. Предэкспоненциальный множитель
Из уравнения Аррениуса следует, что k = А при Еа = 0. Можно было бы предположить, что при этом условии каждое столкновение частиц приводит к химической реакции. Кинетическая теория газов позволяет рассчитать число столкновений частиц в единицу времени (z). Как показывает опыт, не каждое столкновение даже активных молекул приводит к реакции. Необходимо еще одно условие протекания реакции – определенная ориентация молекул, благоприятствующая перераспределению электронной плотности. Поэтому предэкспоненциальный множитель А включает в себя фактор ориентации молекул (вероятностный фактор) Рор :
А = z Рор
Вероятностный фактор уменьшается с ростом числа и сложности реагирующих частиц от доли единицы до 10-9.
Таким образом, предэкспоненциальный множитель отражает частоту столкновения и ориентацию реагирующих частиц.
6.1.7. Зависимость скорости
реакции от катализатора
Катализаторы – вещества, не расходующиеся в результате протекания реакции и не входящие в состав конечных продуктов реакции, но увеличивающие скорость реакции. Катализаторы могут участвовать в образовании промежуточных продуктов реакции, но к концу реакции они полностью регенерируются.
Явление
изменение скорости под действием катализатора называется катализом, а реакции - каталитическими.
Теория каталитических реакций основана на следующих положениях:
а) катализ применим для реакций, в которых для данных условий энергия Гиббса отрицательна (G < 0);
б) в присутствии катализатора изменяется механизм реакции, она протекает через новые стадии с невысокой энергией активации;
в) при катализе не изменяется тепловой эффект реакции;
г) для обратимых реакций катализатор не влияет на равновесие, не меняет константы равновесия и равновесных концентраций;
д) катализатор действует селективно (избирательно).
В настоящее время общепризнано, что катализаторы уменьшают полную энергию активации процесса, т.к. каталитический процесс идет по другому пути, через другое переходное состояние, с образованием других промежуточных частиц. Активированный комплекс с участием катализаторов, имеет меньшую энергию, чем комплекс без катализаторов, поэтому энергия активации каталитической реакции ниже, чем энергия некаталитической реакции, т.е. Еа > Еак. (рис.19).
![]()
 Различают
гомогенный и гетерогенный катализ.
Различают
гомогенный и гетерогенный катализ.
Катализаторы, которые находятся в системе в том же фазовом состоянии, что и реагенты, называются гомогенными. Механизм гомогенного катализа можно объяснить на основе теории промежуточных соединений. Большой вклад в развитие этой теории внесли П. Сабатье (Франция) и Н.Д. Зелинский (Россия). Согласно этой теории, катализатор образует с реагентами промежуточные соединения. Это приводит к уменьшению энергии активации реакции. Например, реакция:
АВ + D → A…B…D → A + BD
в присутствии катализатора К может проходить по схеме:
D + K ![]() D…K
D…K ![]() DK
DK
DK + AB ![]() A…B…D…K → A + BD
+ K
A…B…D…K → A + BD
+ K
Катализатор, как видим, не входит в продукты и не изменяет своего состава.
Примером каталитической гомогенной реакции является процесс окисления оксида углерода в присутствии паров воды:
2СО + О2 ![]() 2СО2.
2СО2.
Если катализаторы и реагенты находятся в разных фазах и имеют границу раздела, то катализ называется гетерогенным. Катализатор является твердым веществом, а реагирующие вещества – газы или жидкости. Реагирующие молекулы адсорбируются на поверхности катализатора, и за счет ориентации определенным образом и ослабления внутримолекулярных связей снижается энергия активации и увеличивается скорость реакции.
Пусть в отсутствии катализатора протекает реакция
А + В = АВ* = Продукты,
а в присутствии катализатора скорость ее возрастает, но продукты остаются теми же. Если считать, что активное адсорбционное состояние аналогично активированному комплексу АВ некаталитической реакции, то весь процесс можно изобразить следующим образом.
1. Адсорбция исходных веществ на поверхность катализатора:
А + В + Кт = АВКт
Как правило, этот процесс экзотермический.
2. Перевод адсорбированного состояния в активное:
АВКт = АВКт*
Этот процесс требует затраты энергии, называемой истинной энергией активации.
3. Реакция в адсорбированном состоянии с образованием адсорбированных конечных продуктов:
АВКт* = Продукты Кт
4. Десорбция продуктов реакции, приводящая к регенерации катализатора:
Продукты Кт = Продукты + Кт
Таким образом, и в гетерогенном катализе ускоряющее действие катализатора, так же как и в гомогенном катализе, связано с тем, что реагирующие вещества образуют промежуточные соединения, что приводит к снижению энергии активации.