Химия изучает состав, структуру и свойства веществ, а также процессы их
получения и превращения. На основе достижений химии развивается электроматериаловедение.
В настоящее время известно примерно 3
млн. органических веществ и около 100 тыс. неорганических веществ. По мере
развития химии их количество растет. Инженеры специальностей радиотелефонной и
телекоммуникационной связи должны знать специальные разделы химии о составе,
структуре и свойствах веществ, электрических свойствах молекул, общих свойствах
и методах получения полимеров, их переработке в электроматериалы и в
изделия.
1. СТРУКТУРА И СВОЙСТВА
ВЕЩЕСТВ
1.1.
Химическая связь и структура молекул
Устойчивое состояние
простых веществ обусловлено соединением атомов в молекулы: H2,
O2,
Cl2,
а не О, Н,
Cl.
Образование молекул происходит за счет
химической связи. Виды химической связи: ковалентная (неполярная, полярная),
ионная, донорно–акцепторная, металлическая,
межмолекулярная.
1. Ковалентная неполярная связь
возникает при образовании общих электронных пар и при перекрывании электронных
облаков, равномерно расположенных между ядрами одноименных атомов. Она
наблюдается в таких полимерно–кристаллических
веществах как, алмаз, сера. Такие вещества обладают высокими диэлектрическими
свойствами.
2. Ковалентная полярная
(гомеополярная) связь возникает между атомами разных элементов. Возникающая
область перекрывания электронных облаков смещена к более электроотрицательному
элементу. Этот вид связи распространен в органических и элементорганических
соединениях, имеющих связи C-O, C-H,
C-N,
C-S
и другие. Длина связи зависит от размера атомов и количества связей и
изменяется от 0,076 до 0,177 нм. В зависимости от числа валентных
электронов и числа образующихся связей молекулы имеют определенную геометрическую
форму или структуру. Так у углерода в молекулах органических соединений
возможны следующие структуры молекул.
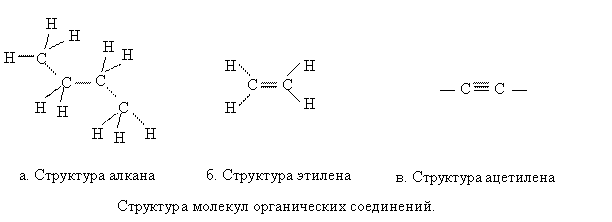
Если
углерод образует связи с четырьмя атомами, что соответствует sp3 гибридизации, то
структура – тетраэдрическая с валентным углом 109°. Если углерод образует три
связи – этиленовая плоская структура, две связи –
ацетиленовая линейная. Валентные углы при этом изменяются в пределах от 109° до
120°.
Каждая ковалентная связь имеет свою
энергию связи. Чем больше выделяется энергии при образовании связи, тем связь
прочнее. Двойная связь прочней, чем одинарная, а тройная еще более прочная.
Величина энергии связи составляет от 200 до 1000 кДж/моль.
3. Ионная связь
характеризуется притяжением положительных и отрицательных ионов между собой.
Обычно она возникает между металлами и неметаллами. Типичные
ионные связи в щелочно–галоидных соединениях –
NaCl
Na0
– 1eˉ
→ Na+
Cl0 + 1eˉ
→ Clˉ
Энергия ионной связи кроме энергии электростатического
взаимодействия ионов Wэ включает энергию сродства к электрону атома неметалла Wср и энергию ионизации атома
металла Wи. Расчетное значение энергии ионной связи молекулы NaCl
WNaCl = - Wи + Wср + Wэ = - 5.1 + 3.7
+ 5.7 = 4.3 эВ = 420 кДж/моль,
что
согласуется с экспериментальным значением –
411 кДж/моль.
4. Донорно–акцепторная
связь. Характеризуется тем, что атомы примесей некоторых элементов
отдают по одному электрону в кристаллическую решетку основного элемента. Такие
атомы (имеющие пары электронов) называются донорами, а примесные
атомы, которые захватывают электроны из основного элемента, называются акцепторами.
Примесные атомы имеют малую энергию связи с
электронами, по сравнению с атомами основного элемента. Поэтому доноры являются
поставщиками электронов в зону проводимости, создавая проводимость n-
типа, а акцепторы – дырок в валентную зону, создавая проводимость p-
типа. Таким образом, легирующие примеси некоторых элементов в кристаллической
структуре веществ, создавая донорно–акцепторные
связи, значительно увеличивают проводимость полупроводника.
Примером веществ, в
которых наблюдается донорно–акцепторная связь, служат
элементы IV
группы периодической системы, например, германий с донорной
примесью мышьяка и акцепторной примесью индия и кремний с донорной
примесью фосфора и акцепторной примесью бора или алюминия.
5. Металлическая связь
возникает в металлах. Их большинство в периодической системе. Они имеют
кристаллическое строение и характеризуются особыми свойствами:
·
высокая электрическая проводимость (106 – 108 См·мˉ1);
·
высокая теплопроводность (от долей
единиц до 420 Вт/(К·м));
·
высокая ковкость;
·
пластичность;
·
металлический блеск и высокая
отражательная способность по отношению к свету.
Энергия связи атомов металле составляет
от 100 до 400 кДж/моль.
У большинства металлов на внешней
электронной оболочке малое число электронов (1, 2, 3) и большое число вакантных
орбиталей. Поэтому энергетически выгодно, чтобы электроны не были локализованы,
а принадлежали всему металлу. Согласно теории свободных электронов в узлах
решетки металла находятся положительно заряженные ионы,
которые погружены в "электронный газ".
Между положительными ионами металла и нелокализованными отрицательными электронами существует
электростатическое взаимодействие, обеспечивающее устойчивость вещества. Эти
электроны и создают высокую электропроводность, теплопроводность, ковкость
пластичность и пр.
6. Межмолекулярная связь
(силы Ван-дер-Ваальса). Это наиболее общий вид связи. Характеризуется как силой
притяжения молекул в веществе между собой, так и силой их отталкивания. При
этом образуются молярные структуры (мицеллы, фибриллы, глобулы, микрокристаллы)
за счет притяжения между низкомолекулярными и особенно высокомолекулярными
молекулами, что имеет большое значение для диэлектрических, механических и физических
свойств (прочность, твердость, эластичность, прозрачность, влагопроницаемость).
Энергия Ван-дер-Ваальсовых взаимодействий невысока:
от 10 до 60 кДж/моль. Силы Ван-дер-Ваальса проявляются при взаимодействии
молекул с насыщенными связями H2, O2, N2, CH4, Ar, Ne.
Различают
следующие разновидности межмолекулярной связи.
а) Водородная связь – связь между
атомом водорода, соединенным ковалентной связью с каким либо атомом в одной
молекуле и более электроотрицательным атомом (фтором, хлором, серой, азотом, кислородом
и др.) в другой молекуле.
б) Ориентационное взаимодействие наблюдается у дипольных (полярных ) молекул, притягивающихся друг к другу при сближении
разноименных по заряду концов диполей. Молекулы при этом взаимно ориентируются,
преодолевая дезориентирующее влияние теплового движения. Наибольшая взаимная
ориентация достигается при низких температурах.

в) Индукционное
притяжение наблюдается также у полярных молекул. Диполи (полюса)
молекул могут воздействовать на неполярные молекулы, превращая их в
индуцированные (наведенные) диполи:
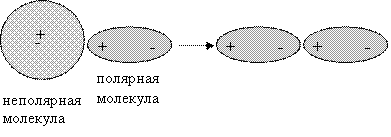
г) Дисперсионное
взаимодействие. В любой молекуле возникают флуктуации (случайное
отклонение от среднего значения) электрической плотности, в результате чего появляются
мгновенные диполи, которые в свою очередь индуцируют мгновенные диполи у
соседних молекул и происходит взаимное притяжение.
Движение мгновенных диполей становится
согласованным, их появление и распад происходит синхронно.
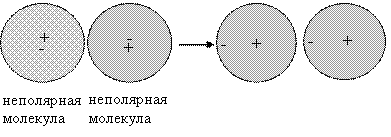
Энергию
межмолекулярных взаимодействий можно записать в виде
W = Wор + Wинд + Wдисп,
тогда
вклад каждого из взаимодействий в суммарную энергию можно проиллюстрировать
таблицей, где полярность молекулы уменьшается сверху вниз.
|
вещество |
вид взаимодействия |
||
|
дисперсионное % |
индуцированное % |
ориентационное % |
|
|
вода |
19 |
4 |
77 |
|
аммиак |
50 |
5 |
45 |
|
хлористый
водород |
81 |
4 |
15 |
|
окись
углерода |
100 |
- |
- |
Связь
Ван-дер-Ваальса – наиболее универсальное и дальнодействующее взаимодействие с
энергией, не превышающей 20 кДж/моль. Взаимодействие обеспечивает существование
в жидком и твердом состояниях инертных газов, газов, молекулы которых имеют
заполненные электронные оболочки (водорода, азот, кислород), многих
органических и неорганических соединений. Вещества, в которых этот тип связи
преобладает, мало устойчивы, летучи, имеют низкие температуры плавления.
Ионная
связь является наиболее распространенной в неорганических соединениях (NaCl, Al2O3, MgO). Энергия взаимодействия достигает до 106 Дж/моль. Вещества с ионным типом связи имеют высокие температуры
плавления и сублимации.
Ковалентная
связь широко распространена в органических соединениях, встречается также и в
неорганических веществах (например, С, Ge, Si). Энергия взаимодействия достигает до 106 Дж/моль. Вещества в твердом состоянии имеют высокие температуры
плавления и сублимации.
Металлическая
связь характерна для металлов. Энергия связи достаточно высока – до 105 дж/моль.
В
веществе каждая связей в чистом виде почти не встречается, но одна из них
играет преобладающую роль, определяя структуру и свойства вещества.
1.2. Агрегатные состояния вещества
Существует три
основных агрегатных состояния вещества: твердое, жидкое, газообразное. В
природе наблюдаются и другие состояния веществ.
Газообразное
– в нем энергия межмолекулярного взаимодействия частиц меньше их кинетической
энергии: Wм.в. < Wк
Поэтому молекулы
(атомы) газа не удерживаются вместе, а свободно перемещаются в объеме. Силы
межмолекулярного взаимодействия появляются тогда, когда молекулы подходят
близко друг к другу. Слабое межмолекулярное взаимодействие обуславливает малую
плотность газа, стремление к безграничному расширению, способность оказывать
давление на стенки сосуда. Молекулы газа находятся в беспорядочном хаотичном
движении. В газе отсутствует порядок расположения частиц. Обычно состояние газа
характеризуют параметрами состояния T,
p
и V.
При малых давлениях р и высоких температурах Т газы ведут себя приблизительно
одинаково. Но уже при обычных температурах Т,
и особенно пониженных температурах Т,
и высоких давлениях р начинают проявляться
индивидуальности газа. Повышение давления р и понижение
температуры Т
сближает частицы газа, начинает проявляться межмолекулярное взаимодействие в
большей степени. Для расчета параметров таких газов уже нельзя применять
уравнение Клайперона – Менделеева
pV = n·R·T,
а можно применять
видоизмененное уравнение Ван – дер
- Ваальса:
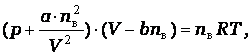
где
- а и b – постоянные члены, учитывающие
наличие сил притяжения между молекулами и собственный объем молекул;
nв = mв/Mв
количество молей
газа;
V – объем
газа.
Жидкое состояние
– в нем энергия межмолекулярного
взаимодействия частиц соизмерима с кинетической энергией движения частиц: Wм.в. ≈ Wк.
Жидкое состояние
является промежуточным между газообразным и
кристаллическим. Сходство жидкостей с газами: текучи, изотропны (одинаковые
свойства во всех направлениях). Сходство с твердыми телами – высокая плотность
и малая сжимаемость. Жидкость легко изменяет свою форму, т.е. в ней отсутствуют
прочные межмолекулярные взаимодействия. Но в то же время низкая сжимаемость
жидкостей, позволяет сохранять при постоянной температуре объем и указывает на
присутствие сил взаимодействия между частицами.
Степень
упорядоченности частиц у различных жидкостей различна и изменяется с изменением
температуры. При низких температурах она велика, с ростом температуры она
падает, приближаясь к свойствам газа. При критической температуре различие
между жидкостью и газом исчезает.
Наряду с обычными
жидкостями с изотропной структурой встречаются анизотропные жидкости или жидкие
кристаллы, которые характеризуются некоторой ориентацией молекул.
Анизотропность жидких кристаллов проявляется в двойном лучепреломлении.
Существующие теории строения жидких кристаллов основаны на представлении о
взаимном ориентирующем действии молекул жидкости друг на друга, вследствие чего
оси молекул располагаются в определенных направлениях.
Некоторые вещества в
жидкокристаллическом состоянии способны смешиваться и образовывать жидкие
кристаллы, аналогичные растворам твердых веществ. При некоторой температуре,
называемой температурой просветления, они переходят в обычное жидкое состояние
и становятся прозрачными. Структура жидких кристаллов изменяется также под
воздействием электрических и магнитных полей и механических воздействий.
Наличие этих свойств позволило применять жидкие кристаллы для изготовления
экранов дисплеев, микрокалькуляторов, циферблатов часов, измерительных приборов
в медицине и т.д.
Твердое состояние
характеризуется тем, что энергия взаимодействия его частиц между собой выше
кинетической энергии их движения:
Wм.в. > Wк.
Твердые вещества
могут находиться в аморфном или кристаллическом состояниях.
а) Аморфное
состояние вещества. В этом состоянии вещества не имеют упорядоченной
структуры. У них, как и у жидких веществ, наблюдается только ближний порядок в
расположении атомов, поэтому вещества в аморфном состоянии еще называют переохлажденными
жидкостями с аномально высокой вязкостью. Некоторые из них очень медленно
текут. Наиболее известное из аморфных веществ – стекло, поэтому аморфное
состояние еще называют стеклообразным. Аморфными являются также многие
полимеры, смолы, простые вещества (Se, Si, Ag
и др.), оксиды (SiO2, GeO2,
B2O3 и др.), сульфаты,
карбонаты, некоторые многокомпонентные неорганические соединения.
Аморфные вещества
изотропны, т.е. имеют одинаковые свойства во всех направлениях. Кроме того,
аморфные вещества плавятся не при строго определенной температуре, а в
некотором температурном интервале.
б) Кристаллическое
состояние вещества характеризуется дальним порядком, т.е. трехмерной
периодичностью структуры по всему объему твердого тела. Регулярное расположение
частиц в твердом теле изображается в виде решетки, в узлах которой находятся
частицы, соединенные воображаемыми линиями.
Монокристаллы
(одиночные кристаллы) характеризуются анизотропностью,
т.е. зависимостью свойств от направления в пространстве.
Кристаллические
вещества плавятся при определенной температуре, tпл.
Она остается постоянной, пока все кристаллическое вещество не расплавится.
Кристаллы
характеризуются энергией и постоянной кристаллической решетки, и
координационным числом.
Координационное
число – это число частиц, примыкающих к данной частице в
кристалле. Чем больше координационное число, тем плотнее упаковка кристалла.
Постоянная решетки
характеризует расстояния между центрами частиц, занимающих узлы в кристалле.
Энергия
кристаллической решетки – энергия (кДж/моль),
необходимая для разрушения одного моля кристалла (удаление частиц за пределы
взаимодействия). Основной вклад вносит энергия химической связи между частицами
в решетке.
1.3. Кристаллические структуры. Строение кристаллов
Наименьшей
структурной единицей кристалла, которая выражает
все свойства его симметрии, является элементарная ячейка. При многократном
повторении ячейки по трем измерениям получают всю кристаллическую решетку.
Решетка, построенная переносом
(трансляцией) одного узла называется решеткой Браве.
Существует семь основных ячеек,
называемых простыми (примитивными), которые различаются
постоянными решетки a,
b,
с и углами между
характеристическими осями α, β
и γ.
Типы
элементарных ячеек:
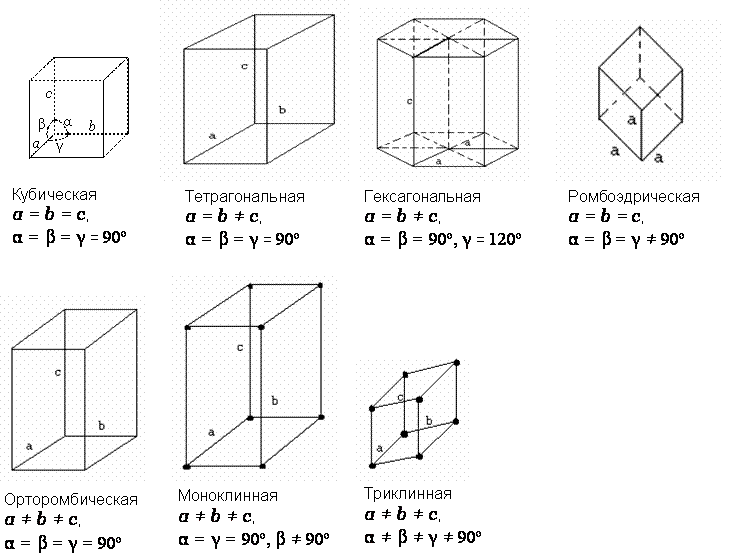
В
кристаллах кубической системы взаимно перпендикулярные рёбра элементарной
ячейки имеют одинаковую длину a.
Тетрагональные
кристаллы: 2 равных ребра длиной а и третье ребро длиной с; все рёбра
взаимно перпендикулярны.
Гексагональные
или тригональные кристаллы: 2 равных ребра длиной а образуют между собой угол 120 и третье ребро длиной с расположено под прямым углом к первым двум.
Ромбические
(орторомбические) кристаллы: 3 неравные ребра длиной a, b, c, взаимно перпендикулярные.
Моноклинные
кристаллы: 2 ребра (a и c) образуют между
собой угол β, а третье ребро b расположено под прямым углом к
рёбрам a и c.
Триклинные кристаллы: 3 ребра a, b и c образуют между собой углы α, β и γ.
Кроме простых или примитивных
элементарных ячеек имеются еще семь сложных, содержащих атомы также в других
точках, например, кубическая объемоцентрированная
(дополнительный атом находится на пересечении главных диагоналей куба),
кубическая гранецентрированная (дополнительные атомы находятся на пересечении
диагоналей граней куба).
Тип кристаллической системы
определяется природой и размерами частиц, видом химических связей между ними,
температурой и другими факторами. Частицы размещаются в решетке так, чтобы энергия
системы была минимальна. Для частиц сферической формы это достигается при
максимальном координационном числе, т.е. при наиболее плотной упаковке.
Некоторые вещества близкие по
химической природе образуют одинаковые кристаллические структуры. Такие вещества
называют изоморфными. В таких структурах частицы могут замещать друг друга,
например Mg2+
и Ca2+
в Ca2SiO4
и Mg2SiO4
или Al3+
и Cr3в
квасцах KAl(SO4)2·12H2O
При замещении даже части ионов могут
изменяться свойства вещества. Например, при замещении части Al3+ +
в корунде Al2O3 на ионы Cr3+ прозрачные кристаллы
становятся красными (рубин), а на ионы Ti3+ и Fe3+ - синими (сапфир).
Многие соединения могут существовать
также в двух или более кристаллических структурах. Такое явление называется
полиморфизмом.
Существует SiO2
– в виде гексагонального кварца, SiO2
– ромбический тридимит и SiO2
– кубический кристобалит. Полиморфные модификации
существуют и у большинства простых веществ, в этом случае они называются аллотропными (по форме) модификациями. Примеры аллотропных модификаций углерода: алмаз, графит, карбин и фуллерен (С60,
С70).
Карбин открыт в
1.4. Кристаллические структуры.
Типы кристаллических твердых тел
По природе частиц в узлах
кристаллической решетки и химических связей между ними все кристаллы
подразделяются:
1.
Молекулярные
кристаллы. В узлах решеток находятся молекулы, между которыми
действуют вандерваальсовы силы, имеющие невысокую
энергию. Это и определяет свойства молекулярных кристаллов. Вещества с
молекулами сферической формы имеют структуру плотной упаковки. Кристаллы с
полярными молекулами в узлах имеют более высокую прочность и температуру
плавления, чем кристаллы с неполярными молекулами в узлах.
2.
Атомно-ковалентные
кристаллы. В узлах кристаллов располагаются атомы, образующие прочные
ковалентные связи. Это обуславливает высокую энергию решетки и физические
свойства веществ. Из-за направленности ковалентных связей координационное число
и плотность упаковки в атомно-ковалентных кристаллах обычно не велики. Так, в
кристалле алмаза углерод имеет sp3
– гибридизацию и координационное число 4.
3.
Ионные
кристаллы. Структурными единицами кристаллов этого типа являются (+) и (-) ионы, между которыми происходит
электростатическое взаимодействие, с высокой энергией. Этим объясняются
свойства веществ, относящихся к ионным кристаллам. Из-за ненаправленности
и ненасыщаемости связей и сферической формы частиц
координационные числа у ионов могут быть высокими, как у NaCl и КCl. У соединений со
сложными ионами, форма кристаллической решетки искажается.
4.
Металлические
кристаллы. Большинство элементов периодической системы Д.И.
Менделеева относятся к металлам, имеющим особые свойства (высокую
электропроводность, теплопроводность, ковкость, пластичность, металлический
блеск и отражательная способность) за счет металлической связи. У металлов на
внешней электронной оболочке мало электронов и много вакантных орбиталей.
Валентные электроны нелокализованы, легко отрываются.
Между положительными ионами металла и электронами существует электростатическое
взаимодействие, обеспечивающее устойчивость вещества. Энергия этого
взаимодействия является промежуточной между энергией ковалентных и молекулярных
кристаллов. Поэтому элементы с чисто металлической связью (s и
p
- металлы) характеризуются невысокой температурой плавления и твердостью.
Наличие электронов, свободно перемещающихся по объему кристалла, обеспечивают
высокую электропроводность и теплопроводность, ковкость и пластичность.
Металлический блеск обусловлен отражением световых лучей от электронного газа.
Из-за ненаправленности связей, сферической формы и одинакового
размера ионов, металлы кристаллизуются в плотноупакованных гексагональных или
кубических гранецентрированных структурах.
Кристаллы
со смешанными связями. Обычно чистые связи в кристаллах
встречаются редко. Чаще между частицами существуют сложные взаимодействия,
которые можно описать наложением двух или более видов связей.
Так в Н2О, НF
кроме вандерваальсовых сил возникают водородные
связи, которые повышают прочность кристаллов.
В ионных кристаллах также действует
ковалентная связь. Поэтому можно говорить о степени ионности,
которая возрастает с увеличением разности электроотрицательностей
частиц в кристалле.
У d и f – металлов наряду с
нелокализованной металлической связью могут действовать также локализованные
ковалентные связи между атомами с неспаренными d
и f
– электронами. В этом случае возрастает энергия кристаллов, температура
плавления и прочность металлов.
В атомных кристаллах наряду с
ковалентной связью могут существовать вандерваальсовы
силы, например в графите. У него при образовании кристаллов происходит sp2
– гибридизация с образованием плоских структур с валентными углами 120°.
Четвертый валентный р – электрон каждого атома
вступает в π-связь между соседними атомами. Эти π-электроны очень подвижны и
обеспечивают электронную проводимость. Между плоскими слоями графита возникает
слабое вандерваальсово взаимодействие, он мягок,
расслаивается. Его используют как смазку и наполнитель карандашей.
Прочные ковалентные связи обеспечивают
графиту высокую температуру плавления и химическую стойкость, а π-связи – электро-
и теплопроводность.
Наличие низкой энергии связи между
плоскостями позволяет внедряться атомам других элементов, фтору или щелочным
металлам. Образуются соединения – интеркаляты или
слоистые соединения. Процесс вхождения молекул, ионов или атомов в решетку
называется интеркалированием:
C + xF = CFx.
При этом изменяется электропроводность,
она приближается к проводимости металлов, а иногда ее превосходит. Интеркалирование характерно для других веществ и
соединений, например, TiS2,
V2O5,
MnO.
Интеркаляты
используют для изготовления проводов, соединения графита с фтором и литием
используют в качестве электродов энергоемких химических источников тока.
1.5. Понятие о зонной теории кристаллов
Химическую связь и свойства
кристаллических веществ можно объяснить с позиций метода валентных связей
(В.С.) и с использованием метода молекулярных орбиталей (ММО).
При образовании химической связи
образуются молекулярные орбитали (МО), принадлежащие всей молекуле. Причем при
сложении ΨАО
возникают молекулярные орбитали с низкой энергией – связывающие, а при
вычитании ΨАО
– молекулярные орбитали с высокой энергией – разрыхляющие.
При взаимодействии большого числа атомов и электронов образуется, и большое
число молекулярных орбиталей и уменьшается разность энергий между ними.
Происходит расщепление атомных орбиталей.
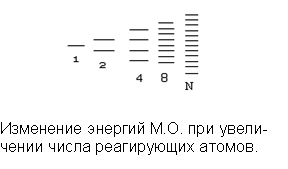
При образовании кристаллов в химические
связи вступает огромное число частиц Ν и
соответственно образуется огромное число МО, охватывающих весь кристалл, и
разность между энергетическими уровнями становится мала. В результате
образуются энергетические зоны, состоящие из огромного числа подуровней.
Разность между верхней и нижней энергиями зоны называется шириной зоны.
В соответствии с принципом минимальной
энергии, заполнение зон электронами происходит в порядке возрастания энергии, а
согласно принципу Паули, на каждой молекулярной орбитали может быть размещено
не более двух электронов с антипараллельными спинами.
Соответственно в s
– зоне – не более 2N электронов, в р
– зоне более 6N
электронов, а в d
– зоне – не более 10N электронов.
Верхняя зона, полностью заполненная электронами, называется валентной
зоной. Зона, свободная от электронов и находящаяся по энергии выше
валентной зоны, называется зоной проводимости.
Валентная зона и зона проводимости
могут либо перекрываться, или не перекрываться друг с другом. Если зоны не
перекрываются, то между ними существует запрещенная зона с шириной ∆W .

Для
полупроводников ∆W
< 4 эВ, для диэлектриков ∆W
> 4 эВ (изоляторы).
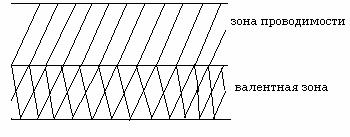
В
металлах запрещенная зона отсутствует.
Ширину запрещенной зоны определяет тип
кристалла: металл, диэлектрик, полупроводник.
Металлы.
У них валентные зоны и зоны проводимости перекрываются. У ѕ- и р- металлов перекрываются внешние ѕ- и р- орбитали. Так как
число электронов на этих орбиталях меньше удвоенного
числа молекулярных орбиталей, то имеется большое число незанятых молекулярных
орбиталей в зоне проводимости. Энергии этих молекулярных орбиталей мало
отличаются друг от друга, поэтому электроны при возбуждении легко переходят с
одной молекулярной орбитали на следующую молекулярную орбиталь, а это
обеспечивает высокую электро- и теплопроводность.
При повышении температуры все большее
число электронов переходит на вакантные молекулярные орбитали в зоне
проводимости, что приводит к уменьшению числа вакантных молекулярных орбиталей
и снижению электрической проводимости.
У d-элементов
происходит перекрывание ns-,
np-
и (n - 1)d – зон. Однако, d – зона относительно
неширокая, поэтому можно считать, что часть d – электронов в металлах локализованы,
т.е. образуются ковалентные связи между соседними атомами и обусловливают
повышение температуры плавления и механической прочности d – элементов и
особенно элементов в середине и в конце периодов (IV – VIII групп) периодической системы.
Диэлектрики
(изоляторы). У них валентная зона и зона
проводимости разделены запрещенной зоной, ширина которой превышает 4 эВ. Для
возбуждения электронов, т.е. их перехода из валентной зоны в зону проводимости,
требуется очень большая энергия, при которой кристалл расплавится или разрушится.
К диэлектрикам относятся многие ионные и молекулярные кристаллы. Ширина запрещенной зоны
в ионных кристаллах возрастает с увеличением разности Э.О. компонентов. Так у NaI – ширина ∆W = 6 эВ, у NaCl - ∆W = 8 эВ. К
диэлектрикам относятся и кристаллы с ковалентными связями: алмаз (∆W=5,1 эВ),
кварц (∆W = 5,2 эВ).
Полупроводники.
При ∆W <
4 эВ кристаллические
вещества проявляют полупроводниковые свойства. При возбуждении электроны
валентной зоны переходят в зону проводимости.

В результате в зоне проводимости (ЗП)
появляются подвижные электроны, а в валентной зоне (ВЗ) – вакансии или
положительно заряженные дырки. Наличие подвижных электронов
и дырок обеспечивает собственную проводимость полупроводников.
При наложении электрического поля появляется движение электронов в одном, а
дырок – в противоположном направлении. Собственную проводимость имеют бездефектные химически чистые (беспримесные) кремний и
германий.
Проводимость полупроводника сильно
изменяется в результате введения примесей в кристаллы.
Если
к кремнию добавить примесь индия, имеющего 3 валентных электрона, то в этом
случае образуются три связи кремния с индием. Для полного октета (8 электронов)
кремнию не хватает 1 электрона, он может перейти на связь из валентной зоны
кремния при возбуждении. Тогда в валентной зоне появится положительно
заряженная вакансия (дырка). Появление дырок обеспечивает проводимость
полупроводника. Примесь индия является акцепторной, а полупроводник
называют полупроводником р-типа.
Если
в кремний Si
ввести элемент V
группы, например, Sb,
у которой 5 валентных электронов, то 4 электрона образуют пары с 4 электронами
кремния, а один из электронов Sb
останется слабо связанным и при возбуждении переходит в зону проводимости,
сообщая кристаллу электронную проводимость. Примесь сурьмы в этом случае
называют донорной, а полупроводник – полупроводником
n – типа.
Итак, зонная теория позволяет объяснить
электрические и тепловые свойства металлов, полупроводников и диэлектриков.
Это четвертое состояние вещества,
широко распространенное во Вселенной. В плазменном состоянии находится 99%
видимой материи. Оно возникает, если кинетическая энергия частиц вещества
превышает энергию ионизации составляющих его атомов: WК
> WИ.
В этом случае возникает ионизированный газ. Вещество представляет собой атомы,
ионы атомов и электроны. В этом состоянии образуются и мгновенно распадаются
объединения этих частиц, и называется такое состояние вещества – плазмой.
При образовании плазмы возможны процессы:
Э –
е → Э+
- ионизация атомов элемента с отрывом электрона;
Э+ + е →Э – процесс
рекомбинации, ведущий к уменьшению концентрации ионов;
Э +
е →Э-
- процесс захвата электронов другими атомами с образованием анионов.
Возникает плазма при нагревании
вещества до очень высоких температур.
Различают низкотемпературную и
высокотемпературную плазму.
Низкотемпературная плазма возникает при температурах от 104 до 105 К.
Для нее характерна невысокая степень ионизации атомов вещества. Такая
плазма присутствует и применяется при дуговой сварке и резке металлов, лампах
дневного света, пламени газовой горелки. Получают ее продуванием холодного газа
через горящий разряд в специальных генераторах плазмы – плазмотронах.
Для высокотемпературной плазмы
требуется температура выше 105 К (степень ионизации близка к 100%). Она
существует на Солнце, во время молний, при термоядерном синтезе.
Для плазмы характерна высокая
электропроводность, близкая к электропроводности металлов. А при повышении
температуры до 108 К
плазма проводит электрический ток в 20 раз лучше, чем медь.
Плазма сильно взаимодействует с
электрическими и магнитными полями. Она квазинейтральна.
1.7.
Промежуточные состояния вещества
В
промежуточной области между аморфным и кристаллическим состоянием вещества
находится нанокристаллическое
состояние, состоящее из нанокристаллов.
Нанокристаллы
– это кристаллы размером от 0,1 до 10 нм (в среднем 1 нм). Размеры атомов в
среднем составляют около 0,2 нм в одном измерении нанокристалла их может уместиться ≈ 10/0,2 =
50, а в трехмерном кристалле 503 = 125·103 –
приблизительно 105 атомов. Это число значительно ниже числа атомов в
обычных кристаллах, равное от 1021 до 1025. Поэтому в наноматериалах до 50% объема занимают атомы, находящиеся на
границах между кристаллами. Состояние этих атомов отличается от состояния
атомов в аморфных или кристаллических веществах. Характерной чертой нанокристаллических материалов является хаотичность границ
между нанокристаллами. В 1 см3 материала
может быть около 1019 разнообразных границ.
Экспериментально установлено, что в нанокристаллах отсутствуют различные дефекты структуры
(дислокации), поэтому нанокристаллы прочнее обычных
кристаллов в 2 – 2,5 раза. Применение нанокристаллических
материалов ведет к экономии металлов и сплавов. Отличаются они по электронным
свойствам от обычных материалов. Перспективно применение нанокристаллов
в создании новых информационных систем.